Artigo Original, Biomed Biopharm Res., 2023; 20(1):13-24
doi: 10.19277/bbr.20.1.305; PDF version [+]; html em inglês [EN]
Avaliação da atividade inibitória da proteína tipo Lisil oxidase 2 (LOXL2) de pimaranos e seus derivados glicosídicos
Sandra Ferreira 1, 4, Patrícia Rijo 1, 2 ![]() , João G. Costa 1
, João G. Costa 1 ![]() , Nuno Saraiva 1
, Nuno Saraiva 1 ![]() , Beatriz Santos 1, Clara Uriel 3, Ana María Goméz 3, A. M. Díaz-Lanza 4 & Ana S. Fernandes 1,4
, Beatriz Santos 1, Clara Uriel 3, Ana María Goméz 3, A. M. Díaz-Lanza 4 & Ana S. Fernandes 1,4 ![]()
1 - CBIOS - Center for Biosciences & Health Technologies, Universidade Lusófona de Humanidades e Tecnologias, Campo Grande 376, 1749-024 Lisboa, Portugal
2 - Instituto de Investigação do Medicamento (iMed.ULisboa), Faculdade de Farmácia, Universidade de Lisboa, 1649-003 Lisboa, Portugal
3 - Instituto de Química Orgánica, CSIC, Juan de la Cierva 3, E-28006 Madrid, Spain
4 - Universidad de Alcalá de Henares. Facultad de Farmacia, Departamento de Ciencias Biomédicas (Área de Farmacología); Ctra. Madrid-Barcelona km. 33,600 28805 Alcalá de Henares, Madrid, Spain
Resumo
A lisil oxidase (LOX) e as proteínas tipo lisil oxidase 1-4 (LOXL 1-4) catalisam a ligação cruzada de elastina e colagénio na matriz extracelular, facilitando a migração e invasão celulares. A inibição destas enzimas, particularmente LOXL2, tem sido sugerida como estratégia terapêutica para prevenir metástases do cancro da mama. Neste trabalho, novos inibidores naturais de LOXL2 foram investigados a partir de Aeollanthus rydingianus, uma planta medicinal rica em produtos bioativos. Cinco diterpenóides de pimarano, dois isolados da planta e três derivados foram testados. Estes compostos foram previamente descritos pelas suas propriedades bioativas, tais como antitumoral, anti-inflamatória, analgésica e antibacteriana. Neste sentido, pretendemos explorar os mecanismos destes compostos, estudando os seus efeitos na atividade da LOXL2. Dois diterpenóides pimaranos mostraram uma ligeira atividade inibitória da LOXL2, avaliada por uma técnica baseada no Amplex Ultra Red. A toxicidade do composto mais ativo foi analisada pelo ensaio MTT na linha celular MDA-MB-231, representativa do cancro da mama triplo negativo. Este composto diminuiu a viabilidade celular como agente isolado e aumentou o efeito citotóxico da doxorubicina. O seu glicoconjugado foi consideravelmente mais tóxico, provavelmente devido a uma maior captação pelas célula tumorais.
Palavras-chave: cancro da mama, proteína tipo lisil oxidase 2, inibidores, pimaranos, Aeollanthus rydingianus, MTT
Como Citar: Ferreira, S., Rijo P., Costa, J. G., Saraiva N., Santos, B., Uriel, C., Goméz, A. M., Díaz-Lanza, A. M., & Fernandes, A. S. (2023) Evaluation of the Lysyl Oxidase-Like 2 (LOXL2) inhibitory activity of pimaranes and their glycosyl derivatives. Biomedical and Biopharmaceutical Research, 20(1), 13-24.
Correspondência a:
Recebido 10/03/2023; Aceite 14/04/2023
Introdução
Lisil oxidase (LOX) e proteínas tipo lisil oxidase 1 a 4 (LOXL1-LOXL4) são aminas oxidase dependentes do cobre que covalentemente se ligam ao colagénio e elastina na matriz extracelular (MEC; Figura 1) (1–3). Estas proteínas LOX/LOXL têm sido implicadas na patogenicidade de várias doenças, incluindo o cancro, uma vez que são expressas em vários tecidos e órgãos (4). Desempenham papéis diferentes, tais como a regulação da transcrição genética e o controlo da proliferação e motilidade celulares(5). A desregulação da expressão destas enzimas tem sido implicada em processos fibróticos, cancro e doenças neurodegenerativas (6–8) . LOXL2 é a mais estudada destas enzimas e apresenta atividades extracelulares e intracelulares (Figura 1) (9) . Extracelularmente, a sua sobreexpressão promove a reticulação do colagénio mediada pela desaminação dos resíduos de lisina, o que aumenta a rigidez da MEC. Tais alterações na densidade e rigidez da MEC promovem a invasão e progressão das células tumorais, através da modulação da integrina (9). A nível intracelular, a LOXL2 promove a ativação de processos que desregulam a transição epitelial-mesenquimatosa. Alguns destes mecanismos são influenciados pelo peróxido de hidrogénio, que é formado durante o processo catalítico desta enzima e está relacionado com os efeitos invasivos da LOXL2 (10).
|
Figura 1 -A) LOXs catalisam a ligação cruzada da elastina e colagénio na matriz extracelular, a qual é mediada pela desaminação dos resíduos de lisina e aumenta a rigidez da matriz extracelular. B)Mecanismos extracelulares e intracelulares das LOX e LOXL 1-4. Estas enzimas, em particular LOXL2, estão implicadas em atividades extracelulares e intracelulares. A nível extracelular, elas causam alterações na densidade e rigidez da matriz extracelular que promovem a invasão e progressão das células tumorais. Intracelularmente, a hipóxia tumoral promove a sobreexpressão da LOXL2, o que irá contribuir para a desregulação da transição epitelial-mesenquimatosa e para os efeitos pró-invasivos da LOXL2. Alguns destes mecanismos são influenciados pela libertação de peróxido de hidrogénio. |
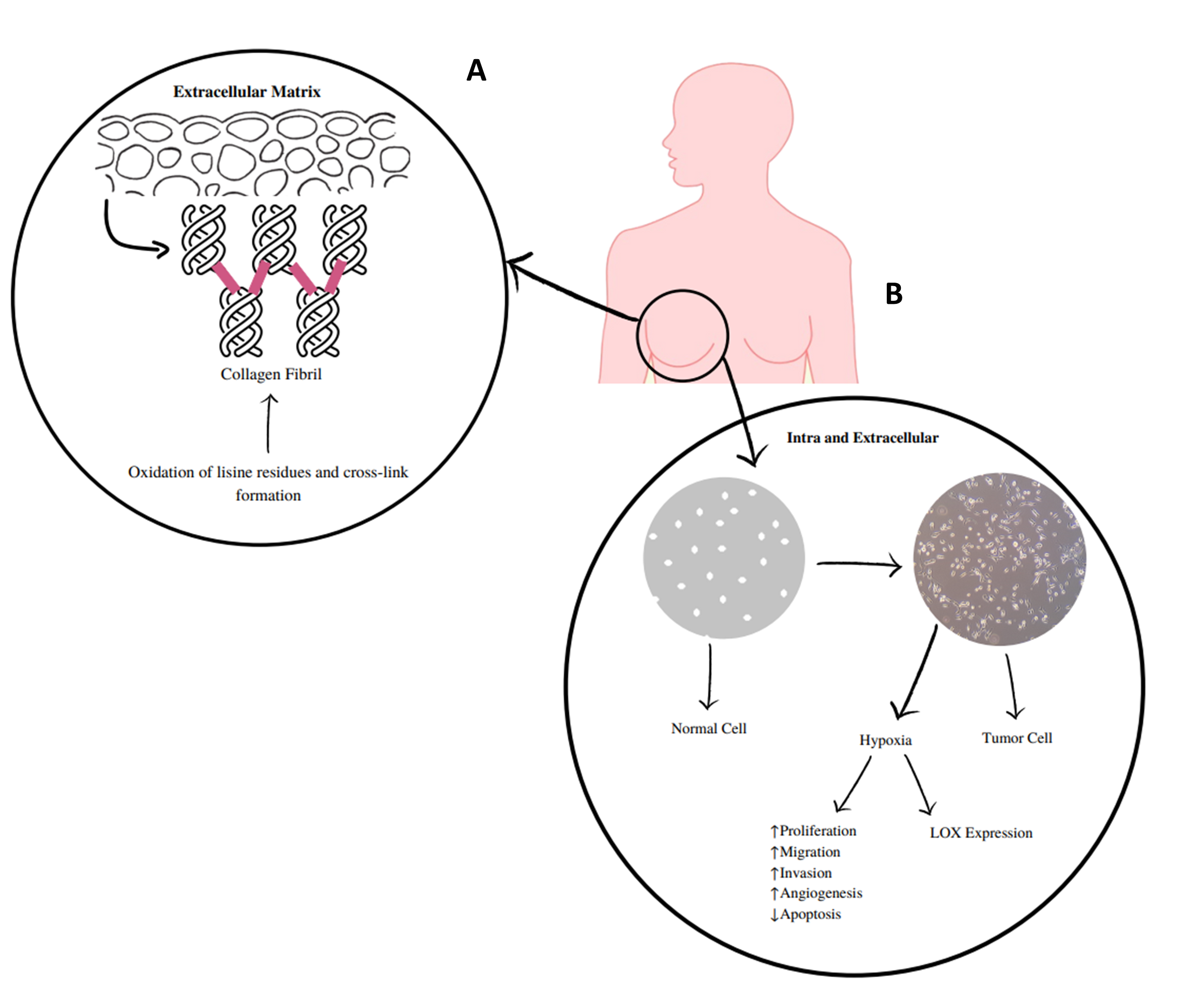 |
LOXL2 tem sido estudada no cancro da mama e particularmente no cancro da mama triplo negativo (CMTN). Este tipo de tumor representa 15% a 20% dos casos de cancro da mama e está fortemente relacionado com a doença metastática (11,12). Estudos anteriores mostraram que a expressão de LOX (13) e LOXL2 (14) está aumentada nos tumores de CMTN. A expressão de LOX e LOXL1-4 também foi estudada na linha celular humana representativa de CMTN, MDA-MB-23, sugerindo que as enzimas LOX e LOXL2 têm a associação mais forte com um fenótipo invasivo/metastático (15). Uma análise bioinformática feita pelo nosso grupo mostrou que a expressão da LOXL2 está associada a uma menor sobrevida livre de doença em doentes com cancro da mama, particularmente nos subtipos triplo negativo e luminal A (16). Além disso, no CMTN, a expressão de LOXL2 correlaciona-se com o aumento de fibroblastos e células endoteliais associadas ao cancro e com a diminuição dos infiltrados linfocitários, que são também características de um pior prognóstico (16). Estes aspetos, juntamente com as escassas opções terapêuticas atualmente disponíveis, tornam o CMTN um candidato adequado para beneficiar da inibição da LOXL2.
As plantas têm sido utilizadas desde a antiguidade como fontes de compostos com atividade terapêutica. De facto, o primeiro inibidor da LOX conhecido foi o β-aminopropionitrilo (BAPN), um composto fitoquímico presente nas ervilhas-doce (Lathyrus odoratus L.) (17,18). Os conhecimentos e tecnologia atualmente disponíveis podem contribuir grandemente para a descoberta de novos fármacos obtidos a partir de plantas tradicionais.
Neste trabalho, foram investigados como potenciais inibidores da LOXL2 humana (hLOXL2) compostos do tipo pimarano, isolados a partir de Aeollanthus rydingianus (Lamiaceae) ou derivados destes. O género Aeollanthus Mart. ex Spreng. (Labiatae) inclui mais de 100 espécies e ocorre principalmente na África Austral e no Brasil. As plantas deste género contêm compostos com atividades biológicas interessantes, incluindo propriedades antimicrobianas, antifúngicas e anticonvulsivantes (19). A espécie aqui estudada, Aeollanthus rydingianus Van Jaarsv. e A.E. van Wyk, cresce no norte da Namíbia e no sul de Angola, em solos relativamente húmidos e ácidos (20). A partir das partes aéreas desta planta, foram isolados diferentes compostos pimaranos (19).Estes compostos bioativos foram descritos pelas suas propriedades terapêuticas como antitumoral, anti-inflamatória, analgésica e antibacteriana (19,21). Os derivados glicosídicos foram incluídos, uma vez que foi descrito que a ligação de uma fração glicosídica a um determinado fármaco melhora a sua eficácia e seletividade para as células cancerígenas. Devido à sua taxa metabólica mais elevada, a absorção de fármacos glicosilados, provavelmente mediada por proteínas transportadoras de glicose, é muito mais elevada nas células cancerígenas do que nas normais. Neste contexto, a glicosilação de compostos naturais bioativos proporcionará propriedades de alvos tumorais, minimizando efeitos sistémicos potencialmente deletérios (22).
Material e métodos
Produtos químicos
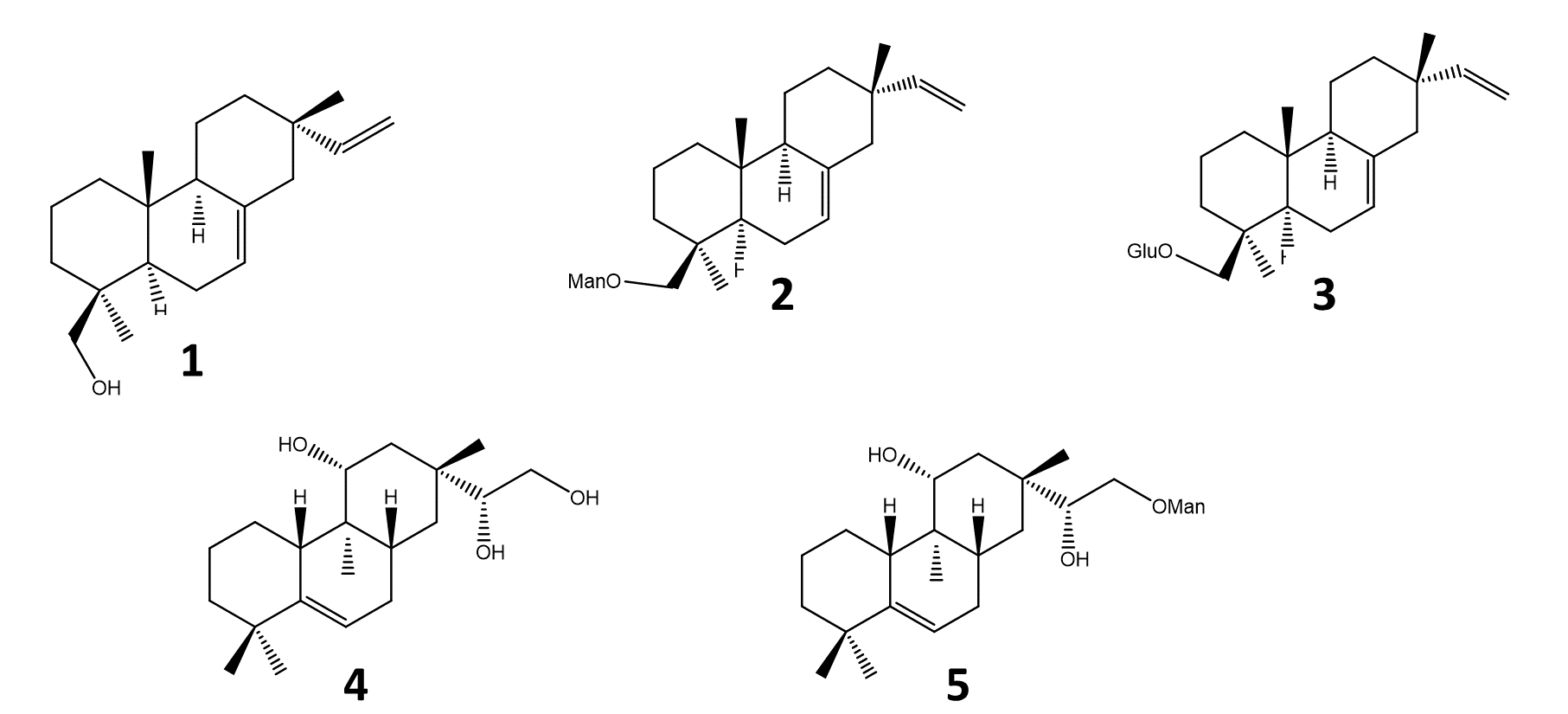
Os compostos de pimarano (Figura 2), 7,15-isopimaradieno-19-ol [1], O-β-D-manoco-piranoside-7,15-isopimaradiene [2], 19-O-β-D-glucopiranoside-7,15-isopimaradiene [3], lagascatriol [4] e lagascatriol-16-O-α-D-manopiranosideo [5] (19,21) foram obtidos como descrito anteriormente (21). A LOXL2 humana foi adquirida à Sino Biological (Pequim, China). Amplex Ultra Red (AUR), borato de sódio e BAPN foram adquiridos à Thermo Fisher Scientific (Waltham, MA, EUA). A ureia foi obtida da VWR International (Darmstadt, Alemanha). O clorito de sódio foi adquirido a José M. Vaz Pereira, S.A (Benavente, Portugal). Dulbecco's Modified Eagle's Medium (DMEM) e soro fetal bovino (FBS) foram adquiridos à Biowest (Nuaillé, França). Foram obtidos da Merck (Darmstadt, Alemanha) peroxidase de rábano (HRP), solução de penicilina-estreptomicina, tripsina, brometo de 3-(4,5-dimetil-2-tiazolil)-2,5-difenil-2H-tetrazólio (MTT), dimetilsulfóxido (DMSO), etanol, e doxorubicina. Matrigel™ foi comprado à BD Biosciences (San Jose, CA, EUA).
|
Figura 2 - Diterpenos pimaranos isolados a partir de Aeollanthus rydingianus (1 e 4) e seus derivados (2, 3 e 5). [1] 7, 15-isopimaradien-19-ol, [2] 19-O-α-D-mannopyranoside-7,15-isopimaradiene, [3] 19-O-β-D-glucopyranoside-7,15-isopimaradiene; [4] lagascatriol; [5] lagasca-triol-16-O-α-D-mannopyranoside. |
 |
Ensaio bioquímico
A atividade da hLOXL2 humana foi determinada pela medição do peróxido de hidrogénio libertado durante a reação, utilizando o reagente AUR na presença do HRP (23,24). Os compostos e a hLOXL2 (10 nM) foram adicionados ao tampão de ensaio (0,05 M de borato de sódio, 1,2 M de ureia, e 0,01 M de cloreto de sódio a pH 8,0), em placas óticas de 96 poços de fundo preto. Após 15 minutos de incubação a 37ºC, foram adicionados cadaverina (0,5 mM), AUR (50 µM) e HRP (0,5 UmL-1). A fluorescência foi medida numa BioTek Synergy HTX, usando um comprimento de onda de excitação de 563 nm e emissão de 587 nm, numa cinética ao longo de 50 minutos. A velocidade da reação foi obtida a partir do declive da região linear da curva. O método foi validado usando BAPN como controlo positivo (24).
Cultura de células
A linha de células humanas de cancro da mama MDA-MB-231 foi obtida da ATCC. As células foram mantidas em DMEM suplementadas com 10% de FBS, 100 U/mL de penicilina e 0,1 mg/ mL de estreptomicina. As culturas foram incubadas a 37 °C, sob uma atmosfera humidificada contendo 5% de CO2 no ar.
Ensaios de viabilidade celular
O efeito dos pimaranos na viabilidade celular, quer aplicados isoladamente quer em combinação com a doxorubicina, foi determinado pelo ensaio do MTT. Em resumo, 6 × 103 células, foram cultivadas em 200 μL de meio completo em placas de 96 poços. As células foram mantidas durante 24 h e depois expostas a diferentes concentrações de pimaranos e/ou doxorubicina (1 e 5 μM), durante um período de 24 h ou 48 h. O ensaio de redução do MTT foi realizado como descrito anteriormente (25). Foram realizadas três a sete experiências independentes e foram realizados cinco replicados para cada condição. Os valores de IC50 foram calculados no software GraphPad (versão 8), utilizando o logaritmo das concentrações versus a percentagem de viabilidade celular.
Análise Estatística
As diferenças nos valores médios dos resultados foram avaliadas pelo teste de t-Student, depois de avaliar a normalidade e a homogeneidade das variâncias das variáveis contínuas. As análises foram realizadas com o software estatístico SPSS (versão 25, SPSS Inc. Chicago, IL, EUA).
Resultados
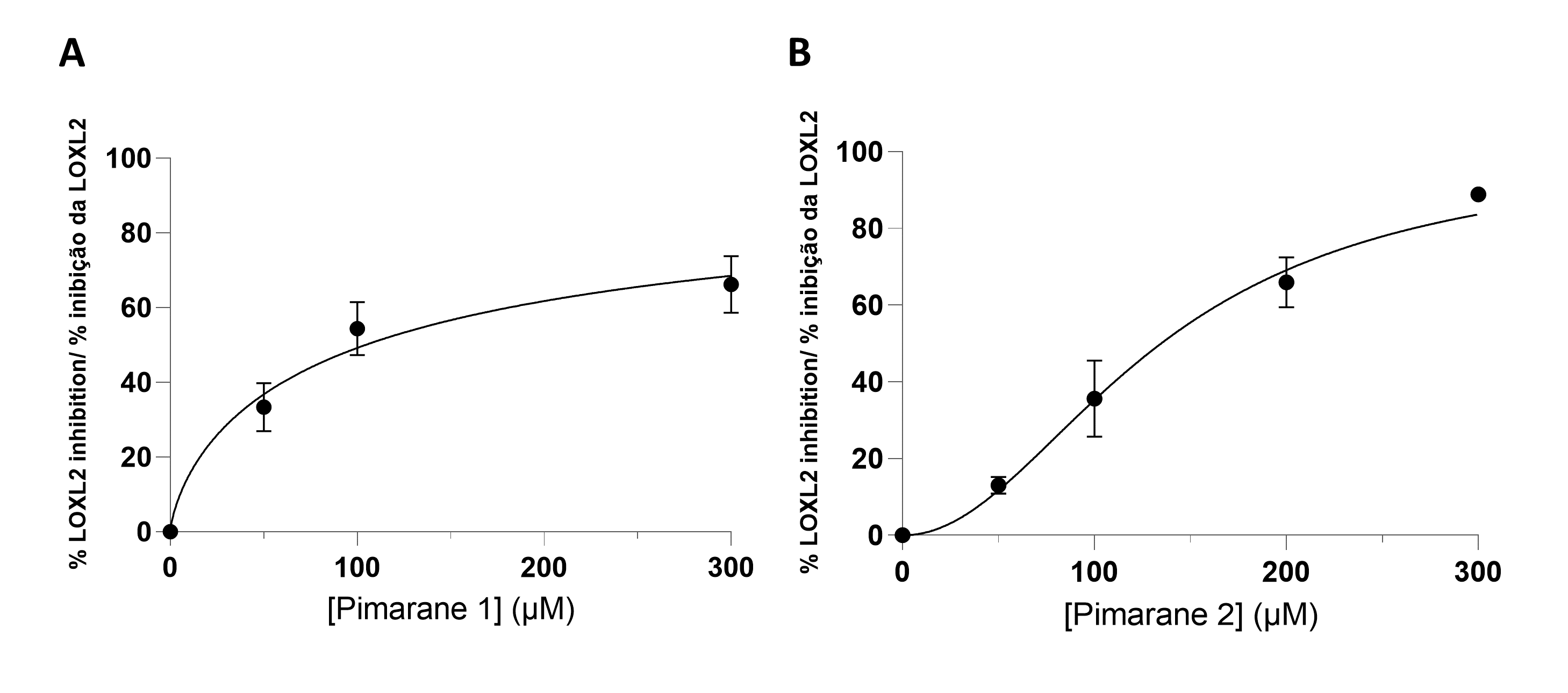
Todos os pimaranos foram inicialmente testados a uma concentração de 100 µM. O pimarano 1, de ocorrência natural, e o seu derivado de manose 2 foram capazes de inibir a hLOXL2. A forma não glicosilada demonstrou ser a mais ativa. As respetivas curvas de concentração-resposta são mostradas na Figura 3. Ambos os compostos exibiram valores de IC50 na gama micromolar: 104 µM para o composto 1 e 134 µM para o composto 2 (Tabela 1). Contrariamente ao composto 1 e ao seu derivado de manose 2, o conjugado de glucose do composto 1 (pimarano 3) não mostrou atividade inibidora de hLOXL2 na concentração de 100 µM. A mesma falta de atividade foi observada para o pimarano natural 4 e para o seu derivado de manose 5.
|
Figura 3 - Ensaio de inibição da LOXL2, de acordo com a técnica Amplex Ultra Red. A) Pimarano 1. B) Pimarano 2. |
 |
|
Tabela 1 - Valores de IC50 para a inibição da hLOXL2, obtidos pela técnica Amplex Ultra Red. BAPN - β-aminopropionitrilo; ND - Não Determinado. |
 |
Os pimaranos 1 e 2, que mostraram atividade inibitória da LOXL2, foram ainda estudados para caracterizar o seu impacto na viabilidade celular. O estudo da citotoxicidade foi realizado na linha celular MDA-MB-231, utilizando o ensaio MTT, após períodos de tratamento de 24 e 48 horas, como descrito na secção anterior. As concentrações dos compostos 1 e 2 foram escolhidas de modo a permitir a definição do perfil de citotoxicidade, ou seja, desde concentrações não tóxicas até concentrações altamente tóxicas. No entanto, no caso da incubação de 24 horas com o composto 1, a solubilidade limitada do composto impediu a realização de estudos com concentrações mais elevadas.
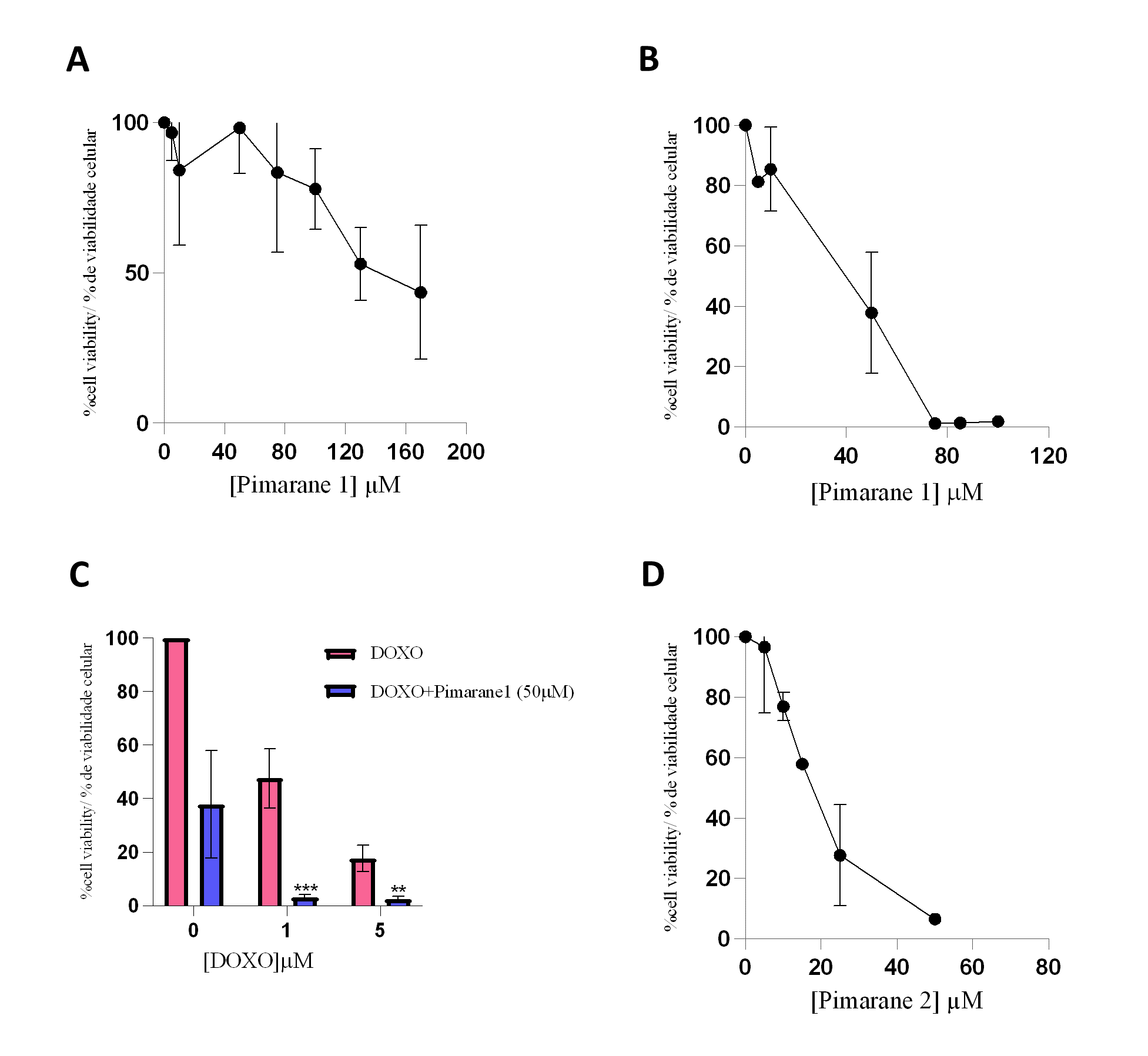
O pimarano 1 exerceu efeitos citotóxicos que eram dependentes da concentração e do tempo, como descrito nas Figuras 4A e 4B. Os valores de IC50 obtidos para este composto foram 113,4 µM (24 h-incubação) e 49,5 µM (48 h-tratamento). Uma vez que a inibição da LOXL2 foi sugerida como estratégia para sensibilizar as células CMTN à terapêutica convencional (26), foi também realizado o estudo de citotoxicidade do pimarano 1 (50 µM) em combinação com a doxorrubicina (1 e 5 µM). Os resultados são mostrados na Figura 4C. Como esperado, a doxorrubicina isoladamente diminuiu a viabilidade celular de uma forma concentração-dependente. Além disso, quando o pimarano 1 foi administrado em combinação com a doxorrubicina, a citotoxicidade foi muito mais pronunciada como consequência de um possível efeito aditivo. A diferença na viabilidade celular das células que receberam o tratamento combinado quando comparada com a viabilidade celular das células apenas expostas à doxorrubicina foi estatisticamente significativa para ambas as concentrações de doxorrubicina (p < 0,01). O pimarano 2 também diminuiu a viabilidade das células MDA-MB-231 de uma forma dependente da concentração (Figura 4 D). Este composto mostrou um valor de IC50 de 16,6 µM para o tratamento de 24 horas. Comparando ambos os pimaranos, é evidente que o pimarane 2 é consideravelmente mais tóxico do que o pimarano 1.
|
Figura 4 - Impacto dos pimaranos 1 e 2 na viabilidade das células MDA-MD-231, avaliado pelo ensaio do MTT. A) Pimarano 1, 24 horas de incubação. B) Pimarano 1, 48 horas de incubação. C) Co-incubação de pimarano 1 (50 µM) e doxorubicina, 48 horas de incubação; *** p < 0.001 e ** p < 0.01 quando comparado com as células expostas à doxorrubicina D) Pimarane 2, 24 horas de incubação.. |
 |
Discussão e conclusões
Os inibidores da LOXL2 foram sugeridos como um tratamento promissor para prevenir a metastização e a invasão do cancro da mama (3). Entre os diferentes subtipos de cancro da mama, o CMTN parece ser particularmente relevante neste contexto.
Foi realizado um screening de alguns compostos diterpenóides de pimarano com o esqueleto de abietano, obtidos a partir de uma planta de Lameacea. Dos cinco compostos analisados, apenas os pimaranos 1 e 2 demonstraram inibir a atividade da LOXL2. No entanto, embora estes dois compostos tenham inibido a LOXL2, apresentaram valores de IC50 mais elevados quando comparados com o controlo positivo BAPN ou com os inibidores sintéticos da LOXL2 anteriormente relatados na literatura (27–29). As concentrações dos compostos pimaranos 1 e 2 necessárias para uma inibição eficiente da LOXL2 podem ser difíceis de alcançar num eventual contexto clínico.
Para o ensaio da citotoxicidade, foi escolhida a linha celular MDA-MB-231. Estas células são normalmente utilizadas como modelo in vitro de CMTN, uma vez que são altamente agressivas, invasivas e pouco diferenciadas, e carecem de expressão dos recetores de estrogénio e progesterona, bem como de amplificação de HER2 (recetor do fator de crescimento epidérmico humano 2). Além disso, estas células expressam níveis elevados de LOXL2, e a sua invasividade é mediada pela degradação proteolítica da matriz extracelular. Para o ensaio combinatório, foi utilizado o fármaco antineoplásico doxorrubicina, uma vez que é amplamente utilizado em regimes de quimioterapia para o cancro da mama metastático (25). Ambos os pimaranos 1 e 2 exibiram uma considerável citotoxicidade nas células MDA-MB-231 em concentrações abaixo das que inibiram a atividade da LOXL2. Estes dados sugerem que embora os compostos pudessem ser mais explorados como potenciais fármacos anticancerígenos, o seu interesse como inibidores da LOXL2 é limitado. Além disso, os mecanismos não relacionados com a inibição da LOXL2 estão provavelmente envolvidos nos efeitos citotóxicos observados. Do mesmo modo, o aumento da citotoxicidade observado quando as células foram simultaneamente expostas ao pimarano 1 e à doxorubicina provavelmente não está relacionado com a inibição da LOXL2, mas é atribuído a outros mecanismos.
Quando se compara a citotoxicidade dos compostos pimaranos 1 e 2, nota-se que o pimarano 2 é ~7 vezes mais tóxico do que o pimarano 1. A diferença estrutural entre estes compostos depende do grupo da manose. A presença do açúcar pode aumentar a absorção de glicoconjugados pelas células cancerígenas, levando a efeitos citotóxicos mais pronunciados. Sabe-se que, devido ao efeito Warburg, os tecidos cancerosos consomem maiores quantidades de glicose em comparação com os tecidos normais. O GLUT-1, o transportador de glicose, é amplamente sobreexpresso numa grande percentagem de cancros humanos, incluindo o cancro da mama (30) . Portanto, a conjugação de agentes anticancerígenos com açúcares permite tirar partido da entrada celular mediada por GLUT para um fornecimento preferencial às células cancerosas, melhorando a eficácia e a seletividade (30). Este facto pode justificar a citotoxicidade diferencial observada para os pimaranos 1 e 2.
A estratégia do presente trabalho poderia ser aplicada ao estudo de outros compostos naturais como potenciais inibidores da LOXL2. Embora os compostos estudados neste trabalho não sejam promissores como novos inibidores da LOXL2, os pimaranos 1 e 2 poderiam ser úteis como ponto de partida para a otimização estrutural no sentido da conceção de inibidores mais potentes, com potencial interesse terapêutico. Além disso, os nossos resultados corroboram a ideia de que a ligação de uma fração de açúcar a um determinado fármaco anticancerígeno poderia constituir uma estratégia orientada para aumentar a eficácia dos medicamentos anticancerígenos contra o cancro da mama.
Contribuições dos Autores
Conceptualização, A.S.F. e P.R.; investigação e análise de dados, S.F, J.G.C., N.S., C.U., A.M.G., D.L.A.M., A.S.F. e P.R.; escrita—preparação do esboço original, S.F; escrita—revisão e edição, A.S.F., J.G.C. e PR; supervisão, A.S.F.; administração do projeto, A.S.F.; aquisição de financiamento, A.S.F. e P.R.; Todos os autores leram e concordaram com a versão publicada do manuscrito.
Financiamento
Este trabalho é financiado por fundos nacionais através da FCT- Fundação para a Ciência e Tecnologia, I.P., ao abrigo dos projetos UIDB/04567/2020 e UIDP/04567/2020. Investigação desenvolvida com financiamento da Universidade Lusófona/ILIND (Programas de Bolsas FIPID 2019/2020 e Fazer+ ILIND/F+/EI/01/2020).
Conflitos de interesse
Os autores declaram não haver conflito de interesses. Os editores envolvidos na autoria desses manuscritos não tiveram participação no processo de revisão ou decisão. Os financiadores não tiveram qualquer papel na conceção do estudo; na recolha, análise, ou interpretação dos dados; na redação do manuscrito, ou na decisão de publicar os resultados.
Referências
1. Rucker, R. B., Kosonen, T., Clegg, M. S., Mitchell, A. E., Rucker, B. R., Uriu-Hare, J. Y., & Keen, C. L. (1998). Copper, lysyl oxidase, and extracellular matrix protein cross-linking. The American journal of clinical nutrition, 67(5 Suppl), 996S–1002S. https://doi.org/10.1093/ajcn/67.5.996S
2. Molnar J., Fong K.S.K., He Q.P., Hayashi K., Kim Y., Fong S.F.T. et al. (2003). Structural and functional diversity of lysyl oxidase and the LOX-like proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 1647(1–2), 220–4. https://doi.org/10.1016/S1570-9639(03)00053-0
3. Ferreira S., Saraiva N., Rijo P., and Fernandes A.S. (2021). LOXL2 Inhibitors and Breast Cancer Progression. Antioxidants, 10(2), 312. https://doi.org/10.3390/antiox10020312
4. Hayashi, K., Fong, K. S., Mercier, F., Boyd, C. D., Csiszar, K., & Hayashi, M. (2004). Comparative immunocytochemical localization of lysyl oxidase (LOX) and the lysyl oxidase-like (LOXL) proteins: changes in the expression of LOXL during development and growth of mouse tissues. Journal of molecular histology, 35(8-9), 845–855. https://doi.org/10.1007/s10735-004-2340-1
5. Barker, H. E., Cox, T. R., & Erler, J. T. (2012). The rationale for targeting the LOX family in cancer. Nature reviews. Cancer, 12(8), 540–552. https://doi.org/10.1038/nrc3319
6. Barry-Hamilton, V., Spangler, R., Marshall, D., McCauley, S., Rodriguez, H. M., Oyasu, M., Mikels, A., Vaysberg, M., Ghermazien, H., Wai, C., Garcia, C. A., Velayo, A. C., Jorgensen, B., Biermann, D., Tsai, D., Green, J., Zaffryar-Eilot, S., Holzer, A., Ogg, S., Thai, D., … Smith, V. (2010). Allosteric inhibition of lysyl oxidase-like-2 impedes the development of a pathologic microenvironment. Nature medicine, 16(9), 1009–1017. https://doi.org/10.1038/nm.2208
7. Yeung, T., Georges, P. C., Flanagan, L. A., Marg, B., Ortiz, M., Funaki, M., Zahir, N., Ming, W., Weaver, V., & Janmey, P. A. (2005). Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell motility and the cytoskeleton, 60(1), 24–34. https://doi.org/10.1002/cm.20041
8. Kumari S., Panda T.K., and Pradhan T. (2017). Lysyl Oxidase: Its Diversity in Health and Diseases. Indian Journal of Clinical Biochemistry, 32(2), 134–41. https://doi.org/10.1007/s12291-016-0576-7
9. Setargew Y.F.I., Wyllie K., Grant R.D., Chitty J.L., and Cox T.R. (2021). Targeting lysyl oxidase family meditated matrix cross‐linking as an anti‐stromal therapy in solid tumours. Cancers, 13(3), 491. https://doi.org/10.3390/cancers13030491
10. Wang W., Wang X., Yao F., and Huang C. (2022). Lysyl Oxidase Family Proteins: Prospective Therapeutic Targets in Cancer. International journal of molecular sciences, 23(20), 12270. https://doi.org/10.3390/ijms232012270
11. Zagami, P., & Carey, L. A. (2022). Triple negative breast cancer: Pitfalls and progress. NPJ breast cancer, 8(1), 95. https://doi.org/10.1038/s41523-022-00468-0
12. Luo C., Wang P., He S., Zhu J., Shi Y., and Wang J. (2022). Progress and Prospect of Immunotherapy for Triple-Negative Breast Cancer. Frontiers in Oncology, 12, 919072. https://doi.org/10.3389/fonc.2022.919072
13. Leo, C., Cotic, C., Pomp, V., Fink, D., & Varga, Z. (2018). Overexpression of Lox in triple-negative breast cancer. Annals of diagnostic pathology, 34, 98–102. https://doi.org/10.1016/j.anndiagpath.2018.03.009
14. Ahn, S. G., Dong, S. M., Oshima, A., Kim, W. H., Lee, H. M., Lee, S. A., Kwon, S. H., Lee, J. H., Lee, J. M., Jeong, J., Lee, H. D., & Green, J. E. (2013). LOXL2 expression is associated with invasiveness and negatively influences survival in breast cancer patients. Breast cancer research and treatment, 141(1), 89–99. https://doi.org/10.1007/s10549-013-2662-3
15. Molani Gol R., and Kheirouri S. (2021). The Effects of Quercetin on the Apoptosis of Human Breast Cancer Cell Lines MCF-7 and MDA-MB-231: A Systematic Review. Nutrition and Cancer, 74(2), 405–22. 10.1080/01635581.2021.1897631
16. Ramos, S., Ferreira, S., Fernandes, A. S., & Saraiva, N. (2022). Lysyl Oxidases Expression and Breast Cancer Progression: A Bioinformatic Analysis. Frontiers in pharmacology, 13, 883998. https://doi.org/10.3389/fphar.2022.883998
17. Sherif H. M. (2010). In search of a new therapeutic target for the treatment of genetically triggered thoracic aortic aneurysms and cardiovascular conditions: insights from human and animal lathyrism. Interactive cardiovascular and thoracic surgery, 11(3), 271–276. https://doi.org/10.1510/icvts.2010.239681
18. Schilling E.D., Strong F.M. (1955). Isolation, Structure and Synthesis of a Lathyrus Factor from L. Odoratus. Journal of the American Chemical Society, 77, 2843–2845.
19. Rijo P., Simões M.F., Duarte A., and Rodríguez B. (2009). Isopimarane diterpenoids from Aeollanthus rydingianus and their antimicrobial activity. Phytochemistry, 70(9), 1161–5. https://doi.org/10.1016/J.PHYTOCHEM.2009.06.008
20. van Jaarsveld A.E.J., and van Wyk A.E. (2005). Notes on african plants The Aeollanthus abyssinicus group (Labiatae). Bothalia 35(2), 157-160. https://doi.org/10.4102/abc.v35i2.391
21. Isca V.M.S., Andrade J., Fernandes A.S., Paixão P., Uriel C., Gómez A.M. et al. (2020). In Vitro Antimicrobial Activity of Isopimarane-Type Diterpenoids. Molecules, 25(18), 4250. https://doi.org/10.3390/molecules25184250
22. Sorg B.L., Hull W.E., Kliem H.C., Mier W., and Wiessler M. (2005). Synthesis and NMR characterization of hydroxyurea and mesylglycol glycoconjugates as drug candidates for targeted cancer chemotherapy. Carbohydrate Research 340(2), 181–9. https://doi.org/10.1016/J.CARRES.2004.11.024
23. Guerreiro, Í., Vidovic, B., Costa, J. G., Martins, M., Ferreira, S., Oliveira, N. G., Saraiva, N., & Fernandes, A. S. (2023). The Dietary Isothiocyanate Erucin Reduces Kidney Cell Motility by Disturbing Tubulin Polymerization. Molecular nutrition & food research, 67(3), e2200581. https://doi.org/10.1002/mnfr.202200581
24. Hutchinson, J. H., Rowbottom, M. W., Lonergan, D., Darlington, J., Prodanovich, P., King, C. D., Evans, J. F., & Bain, G. (2017). Small Molecule Lysyl Oxidase-like 2 (LOXL2) Inhibitors: The Identification of an Inhibitor Selective for LOXL2 over LOX. ACS medicinal chemistry letters, 8(4), 423–427. https://doi.org/10.1021/acsmedchemlett.7b00014
25. Flórido, A., Saraiva, N., Cerqueira, S., Almeida, N., Parsons, M., Batinic-Haberle, I., Miranda, J. P., Costa, J. G., Carrara, G., Castro, M., Oliveira, N. G., & Fernandes, A. S. (2019). The manganese(III) porphyrin MnTnHex-2-PyP5+ modulates intracellular ROS and breast cancer cell migration: Impact on doxorubicin-treated cells. Redox biology, 20, 367–378. https://doi.org/10.1016/j.redox.2018.10.016
26. Cebrià-Costa J.P., Pascual-Reguant L., Gonzalez-Perez A., Serra-Bardenys G., Querol J., Cosín M. et al. (2020). LOXL2-mediated H3K4 oxidation reduces chromatin accessibility in triple-negative breast cancer cells. Oncogene, 39(1), 79–121. https://doi.org/10.1038/s41388-019-0969-1
27. Smithen, D. A., Leung, L. M. H., Challinor, M., Lawrence, R., Tang, H., Niculescu-Duvaz, D., Pearce, S. P., Mcleary, R., Lopes, F., Aljarah, M., Brown, M., Johnson, L., Thomson, G., Marais, R., & Springer, C. (2020). 2-Aminomethylene-5-sulfonylthiazole Inhibitors of Lysyl Oxidase (LOX) and LOXL2 Show Significant Efficacy in Delaying Tumor Growth. Journal of medicinal chemistry, 63(5), 2308–2324. https://doi.org/10.1021/acs.jmedchem.9b01112
28. Leung L., Niculescu-Duvaz D., Smithen D., Lopes F., Callens C., McLeary R. et al. (2019). Anti-metastatic Inhibitors of Lysyl Oxidase (LOX): Design and Structure-Activity Relationships. Journal of medicinal chemistry, 62(12), 5863–84. https://doi.org/10.1021/acs.jmedchem.9b00335
29. Rowbottom M.W., Bain G., Calderon I., Lasof T., Lonergan D., Lai A. et al. (2017). Identification of 4-(Aminomethyl)-6-(trifluoromethyl)-2-(phenoxy)pyridine Derivatives as Potent, Selective, and Orally Efficacious Inhibitors of the Copper-Dependent Amine Oxidase, Lysyl Oxidase-Like 2 (LOXL2).Journal of medicinal chemistry, 60 (10), 4403–23. https://doi.org/10.1021/acs.jmedchem.7b00345
30. Calvaresi, E. C., & Hergenrother, P. J. (2013). Glucose conjugation for the specific targeting and treatment of cancer. Chemical science, 4(6), 2319–2333. https://doi.org/10.1039/C3SC22205E
