| Artigo Original, Biomed Biopharm Res., 2023; 20(1):64-82 doi: 10.19277/bbr.20.1.311; versão PDF [+]; html em inglês [EN] |
O extrato metanólico das folhas de Bauhinia forficata reduziu o nível de creatinina sérica e impediu a elevação das enzimas hepáticas em ratinho expostos a gentamicina e acetaminofeno: um estudo exploratório
Sebastián Funes-Rivera 1,2 ![]() , María L. Kennedy 1
, María L. Kennedy 1 ![]() , Antonia K. Galeano 1
, Antonia K. Galeano 1 ![]() , Patricia M. Funes Torres 2
, Patricia M. Funes Torres 2 ![]() & Miguel A. Campuzano-Bublitz 1
& Miguel A. Campuzano-Bublitz 1 ![]() ✉️
✉️
1 - Departamento de Farmacología, Facultad de Ciencias Químicas, Universidad Nacional de Asunción. Campus UNA, 2169. San Lorenzo. Paraguay
2 - Departamento de Bioquímica Clínica, Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Campus UNA, 2169. San Lorenzo. Paraguay
Resumo
As doenças renais e hepáticas são um problema global de saúde pública. A gestão farmacológica impede geralmente a sua progressão. Atualmente, são desenvolvidos tratamentos alternativos baseados na medicina tradicional e na utilização de plantas medicinais. A Bauhinia forficata está amplamente distribuída na América do Sul e é utilizada pelas suas propriedades hepatoprotectoras e nefroprotectoras. Este estudo foi concebido para avaliar preliminarmente estes efeitos das folhas de B. forficata (50, 100, 200 e 400 mg/kg, per os) em ratinhos. A lesão renal aguda foi induzida com gentamicina (135mg/kg, intraperitoneal), seguida da determinação dos níveis de creatinina, ureia, ácido úrico e electrólitos na urina e no soro. A lesão hepática aguda foi induzida por acetaminofeno (300 mg/kg, intraperitoneal), seguida da determinação de um perfil hepático sérico de aspartato aminotransferase, alanina aminotransferase e fosfatase alcalina. Todas as doses testadas induziram uma redução significativa dos níveis séricos de creatinina, em comparação com os animais não tratados. Além disso, o extrato impediu eficazmente a elevação da atividade das enzimas hepáticas induzida pela acetaminofena. Conclui-se que o extrato das folhas de B. forficata tem efeitos nefroprotectores e hepatoprotectores num modelo de ratinho de hepato e nefrotoxicidade, o que é compatível com a utilização tradicional.
Palavras-chave: Bauhinia forficata, silimarina, creatinina, aspartato aminotransferase, alanina aminotransferase, fosfatase alcalina
Para Citar: Funes-Rivera, S. F., Kennedy, M. L., Galeano, A. K., Funes Torres, P. M. & Campuzano-Bublitz, M. A. (2023) Methanol extract of Bauhinia forficata leaves reduced serum creatinine level and prevented the elevation of hepatic enzymes in mice exposed to gentamicin and acetaminophen: an exploratory study. Biomedical and Biopharmaceutical Research, 20(1), 64-82.
Correspondência a:
Recebido 17/04/2023; Aceite 22/06/2023
Introdução
Os rins e o fígado são órgãos intimamente relacionados com o metabolismo e a desintoxicação das substâncias. Situações de stress, como a sobrecarga metabólica ou a exposição frequente a agentes nocivos, nomeadamente a ação de xenobióticos, comprometem o seu bom funcionamento (1, 2). Os recursos terapêuticos disponíveis são escassos, pelo que é muito importante o estudo de medicamentos alternativos destinados a preservar a funcionalidade destes órgãos (3).
A etiologia da doença renal é variável. Algumas são específicas do indivíduo, de acordo com factores fisiológicos, outras estão relacionadas com patologias subjacentes, como a diabetes ou a hipertensão arterial, ou devem-se a factores directos, como compostos nefrotóxicos como é o caso dos antibióticos aminoglicosídeos (2). A doença renal está já entre as dez primeiras causas de morte em todo o mundo, independentemente da raça, sexo, idade ou localização geográfica. No nosso País, o Paraguai, um total de 366 pacientes necessitaram de hemodiálise em 2010. Em 2019, o número total de pacientes dialisados aumentou para 1638, dos quais 61% eram homens (4). Em todo o mundo, 5 milhões de pessoas morrem anualmente devido à falta de acesso a tratamentos críticos para a doença renal (4). Prevê-se que a doença renal crónica venha em breve a ser a quinta principal causa de morte. Geralmente, com dados epidemiológicos limitados, conhecimentos reduzidos e acesso deficiente a serviços laboratoriais, o verdadeiro ónus da doença renal é subestimado. As doenças renais são patologicamente diversas e são frequentemente assintomáticas. Como tal, são frequentemente diagnosticadas tardiamente e os cuidados prestados aos doentes exigem recursos especializados que aumentam os custos dos cuidados de saúde. A prevenção da doença renal é altamente rentável, mas exige uma abordagem holística multissectorial (5).
O fígado é um órgão crítico do corpo humano, responsável por várias funções, como a secreção de bílis. Está também relacionado com o metabolismo dos hidratos de carbono, lípidos e proteínas, com o processamento de fármacos e hormonas e com a desintoxicação de substâncias como o álcool, fármacos e hormonas através de um processo denominado biotransformação (6). A doença hepática é multifatorial, podendo resultar de desequilíbrios metabólicos, como a deficiência de alfa-1-antitripsina, hemocromatose (doença de Wilson), obesidade, acumulação de fármacos como o paracetamol ou outros xenobióticos no organismo, ou devido a vírus. Assim, é uma doença que pode ocorrer em indivíduos de todas as idades. Uma das principais doenças crónicas do fígado a nível mundial é a cirrose, resultando da obesidade ou do abuso prolongado de bebidas alcoólicas, que afecta principalmente indivíduos entre os 60 e os 80 anos de idade (7). As doenças hepáticas são responsáveis por mais de 2 milhões de mortes (cirrose, hepatite viral e cancro do fígado), ou seja, 4% de todas as mortes. Atualmente, a doença hepática é a 11.ª principal causa de morte, mas as mortes por doença hepática podem estar subestimadas (7).
Os tratamentos farmacológicos actuais tratam principalmente estas condições de forma indireta, reduzindo os factores que podem levar a complicações mais significativas, com determinados efeitos secundários e custos elevados. A silimarina é uma mistura de flavonolignanos extraída das sementes de Silybum marianum utilizada desde a antiguidade para tratar afecções hepáticas crónicas e agudas. Foi demonstrado que previne as lesões hepáticas causadas por várias toxinas, sendo os seus efeitos frequentemente atribuídos às suas propriedades antioxidantes, de eliminação de radicais livres e de quelação do ferro (8).
Várias plantas demonstraram as suas propriedades nefroprotectoras em estudos experimentais em modelos animais, entre elas o Phyllanthus amarus (9), o chá verde (10) e a Eclipta alba (11). Da mesma forma, o extrato aquoso da casca de Bauhinia variegata demonstrou efeitos protectores contra a insuficiência hepática e a nefrotoxicidade causada pela tioacetamida em ratinhos (12) e em ratinhos com lesões hepáticas causadas pelo tetracloreto de carbono (13). A Smallanthus sonchifolius inverteu as lesões hepáticas induzidas pelo acetaminofeno em ratinhos (14) e o extrato de cladódios de Opuntia ficus-indica preveniu as lesões hepáticas induzidas pelo lítio (15). Em trabalhos anteriores, demonstrámos as propriedades hepato- e nefroprotectora da Prosopis ruscifolia (16), Baccharis crispa (17), e Dorstenia brasiliensis (18) em ratinhos.
A Bauhinia forficata (Fabaceae) é uma espécie arbórea cujas folhas são utilizadas em infusão para tratar afecções renais e hepáticas e como agente hipoglicémico. No Brasil, é utilizada como hipolipidémico, diurético, expetorante, tónico, carminativo e digestivo, entre outros usos (19). Também é usado topicamente como adstringente para tratar feridas ou aftas.
O extrato metanólico de B. forficata mostrou boas actividades antioxidantes e hipoglicémicas (19). Com base na sua composição de terpenóides, foi verificada a sua atividade antibacteriana e fungicida. A utilização medicinal tradicional da infusão das folhas de B. forficata não tem registado casos de efeitos adversos tóxicos (19), embora estudos in vitro tenham demonstrado que, dependendo da dose, podem ocorrer danos mitocondriais, bem como actividades mutagénicas e disfunção da tiroide (20, 21).
Os principais constituintes de B. forficate nas folhas são compostos fenólicos, particularmente flavonóides, juntamente com terpenos e esteróides. Os flavonóides são principalmente derivados do kaempferol e da quercetina. Foram também identificados alguns compostos fenólicos, incluindo o ácido gálico, o ácido clorogénico e o ácido cafeico (19, 22).
O uso de terapias naturais para várias doenças tem uma longa história, e a B. forficata tem sido tradicionalmente usada para tratar doenças do fígado e dos rins. O presente trabalho teve como objetivo avaliar o potencial nefroprotector e hepatoprotector do extrato de folhas de Bauhinia forficata. A nefroprotecção foi analisada através da determinação dos perfis renais clássicos, bem como dos perfis urinário e eletrolítico renal. O efeito hepatoprotector foi avaliado através do perfil hepático. Considerando a importância das condições de saúde associadas aos rins e ao fígado, o potencial efeito protetor em ratinhos utilizando o extrato de metanol deste recurso natural é aqui relatado pela primeira vez. O extrato foi capaz de atenuar as lesões renais e hepáticas induzidas quimicamente em ratinhos, evidenciadas pela redução dos níveis de creatinina sérica e pela prevenção da atividade elevada das enzimas hepáticas.
Material e Métodos
Material vegetal e preparação do extrato
As folhas de Bauhinia forficata Link (Fabaceae) foram coletadas na cidade de Itá, Departamento Central, no Paraguai. O material vegetal foi identificado por pesquisadores do Departamento de Botânica. Um espécime prensado e seco está arquivado no herbário da Facultad de Ciencias Químicas da Universidad Nacional de Asunción (FCQ-UNA), sob o código: Degen, González et González 4045. O extrato de B. forficata foi obtido por sonicação das folhas secas e moídas em metanol (x3). O solvente foi removido sob pressão reduzida num evaporador rotativo. O extrato resultante foi armazenado num exsicador até ser utilizado nos ensaios biológicos. Para este efeito, o extrato foi dissolvido em água.
Reagentes e equipamento
Foram utilizados gentamicina (Larjan, Veinfar, Argentina), acetaminofeno (Sigma, St. Louis, MO, EUA), mosilymarin (Sigma, St. Louis, MO, EUA) e pentobarbital sódico (Abbott, Japão). O metanol foi adquirido localmente e destilado antes da utilização. As estimativas dos parâmetros de funcionalidade hepática e renal foram efectuadas com equipamento (Autoanalyzer CB350i) e kits adquiridos ao Wiener Lab (Roma, Itália). As determinações de electrólitos foram feitas com equipamento (Combi-line) e reagentes de Eschweiler (Kiel, Alemanha). Foi utilizada uma microcentrifugadora Hermle Z216M (HERMLE Labortechnik GmbH, Wehingen, Alemanha). As gaiolas metabólicas foram adquiridas à Suzhou Fengshi Laboratory Animal Equipment Co. Ltd (Suzhou City, China). Foram utilizados soros humanos normais e patológicos (Humatrol,Wiesbaden-Alemanha) como controlos de qualidade.
Animais de laboratório e questões éticas
Os testes de toxicidade foram efectuados em ratinhos fêmeas. As experiências de nefro e hepatoprotecção foram realizadas em ratinhos albinos suíços machos adultos (12 semanas de idade), pesando 30 ± 5 g, aparentemente saudáveis, adquiridos no biotério da Facultad de Ciencias Químicas, mantidos em condições laboratoriais normais (aclimatados a uma temperatura de 22 ± 2°C e humidade até 60%, em salas com ciclos de 12/12h de luz/escuridão). Os animais foram alimentados diariamente (6 g/animal) e receberam água ad libitum durante todo o experimento. Para a manipulação dos animais, foram seguidas as normas estabelecidas pela Comissão de Ética da Comunidade Europeia (23). O protocolo do projeto foi aprovado pelo Comité de Ética em Investigação da FCQ (Comité de Ética en Investigación, CEI 471/19). Os animais foram utilizados uma única vez e, para a sua eliminação final, foram entregues a uma empresa especializada na gestão de resíduos biológicos.
Teste de toxicidade oral aguda
Foram seguidas as directrizes para os testes de toxicidade do protocolo número 420 da Organização para a Cooperação e Desenvolvimento Económico (OCDE). Um grupo de cinco ratinhos fêmeas recebeu por via oral, cumulativamente, a cada 24 horas, doses de 5 a 2000 mg/kg de extrato e foram comparados com um grupo de controlo (n=5, água destilada). Os animais foram observados até 8 horas após cada tratamento e, posteriormente, durante um período de 15 dias. A presença de sinais de toxicidade, bem como a sua gravidade, progressão e reversibilidade, foram procuradas e registadas em função da dose e do tempo. No final do período de observação, os principais órgãos foram examinados macroscopicamente (24).
Nefrotoxicidade induzida pela gentamicina e tratamentos
As doses para avaliação do efeito nefroprotector e hepatoprotector em ratinhos foram seleccionadas de acordo com as doses mais elevadas testadas em ensaios de toxicidade aguda. Neste caso, não foi observada qualquer evidência de toxicidade em doses inferiores a 2000 mg/kg. Os ratinhos machos divididos em sete grupos (n=6) receberam o tratamento durante nove dias: controlo (Veh; água, per os); gentamicina (Gent; água 0.1 mL/10g de peso corporal, per os, e gentamicina); droga hepatoprotectora de referência silimarina (Sil; 150 mg/kg de peso corporal, silimarina, dissolvida em etanol: propilenoglicol: água 1:4:5, per os, e gentamicina); Bf 50, Bf 100, Bf 200, Bf 400 (contendo 50, 100, 200 e 400 mg/kg de extrato metanólico de B. forficata, respetivamente, per os, e gentamicina. Exceto no grupo de controlo, os ratinhos receberam a gentamicina (135 mg/kg; intraperitoneal) uma hora após os tratamentos. Esta dose foi padronizada em estudos anteriores nos ratinhos adquiridos no biotério da Faculdade de Ciencias Químicas. O peso de cada ratinho foi registado diariamente. No nono dia, os ratinhos foram transferidos para gaiolas metabólicas individuais durante 24 h para recolher amostras de urina e quantificar o consumo de alimentos (16). A quantidade de alimentos e o volume de água consumidos durante o confinamento na caixa metabólica também foram registados. Após a permanência nas gaiolas metabólicas, todos os animais foram anestesiados com pentobarbital sódico (50 mg/kg, i.p.) e recolhida amostra de sangue.
Hepatotoxicidade induzida por acetaminofeno e tratamentos
Os ratinhos foram divididos em sete grupos (n=6). Foram tratados durante quatro dias: controlo (Veh; água, por via oral); acetaminofeno (APAP; água, por via oral); silimarina (Sil; 150 mg/kg de silimarina, dissolvida em etanol: propilenoglicol: água 1:4:5, por via oral); Bf 50, Bf 100, Bf 200, Bf 400 (com 50, 100, 200 e 400 mg/kg de extrato de B. forficata, respetivamente, por via oral). No quarto dia, duas horas após o tratamento oral, exceto nos animais do grupo de controlo, foi induzida hepatotoxicidade aguda em ratinhos utilizando acetaminofeno (APAP, 300 mg/kg, intraperitoneal). Esta dose foi padronizada em estudos anteriores em ratinhos obtidos no biotério da Faculdade de Ciencias Químicas (16). Três horas após a administração de acetaminofeno, os ratinhos foram anestesiados com pentobarbital sódico (50 mg/kg, i.p.) e recolhida amostra de sangue. A fosfatase alcalina (ALP), a aspartato aminotransferase (transaminase glutâmico-oxaloacética, GOT) e a alanina aminotransferase (transaminase glutâmico-pirúvica, GPT) foram determinadas no soro(16).
Determinação dos parâmetros bioquímicos
No ensaio da atividade nefroprotectora, procedeu-se à exsanguinação dos ratinhos por punção cardíaca sob anestesia, após a remoção das gaiolas metabólicas. O soro foi obtido após incubação do sangue fresco durante 20 minutos a 37°C e centrifugação durante 10 minutos a 3000 rpm. Foram determinadas as concentrações de ureia, creatinina e ácido úrico (mg/dL), bem como de potássio e sódio (mEq/L). Foi medido o volume de urina após 24 horas (mL) e, nesta amostra, foram determinadas as concentrações de creatinina, ureia e ácido úrico (mg/kg/24h), bem como de sódio e potássio (mEq/kg/24h). A concentração de sódio e potássio no soro e na urina foi determinada no medidor de electrólitos Eschweiler Combi-Line. O equipamento foi devidamente calibrado e acreditado sob controlos de qualidade internos e externos antes da determinação dos analitos. Para as determinações no soro foi utilizado o método do elétrodo seletivo de iões direto, referente à determinação de electrólitos em amostras inteiras sem diluição. Para a determinação de electrólitos na urina, foi utilizado o método do elétrodo seletivo de iões indireto, em que a amostra é submetida a uma diluição antes da determinação.
No ensaio de atividade hepatoprotectora, foram determinadas a GOT, a GPT e a ALP. O soro foi obtido após incubação do sangue fresco e depois centrifugado. O controlo de qualidade interno foi efectuado utilizando soro de controlo normal e patológico. As actividades de GOT, GPT e ALP foram determinadas num espetrofotómetro a 340 nm, e os resultados expressos em U/L (25, 26).
Análise estatística
Os resultados correspondem à média ± desvio padrão (DP) considerando p<0,05 como estatisticamente significativo. A ANOVA de uma via e o teste de Dunnett foram efectuados utilizando o GraphPad Prism 7.0. (GraphPad Software, Inc., CA).
Resultados
Os resultados dos testes de toxicidade indicaram que o extrato metanólico de Bauhinia forficata não apresentou um efeito tóxico durante o período de observação. Não foi observada qualquer mortalidade. Não foram observadas diferenças macroscópicas ou evidências de danos entre os órgãos (fígado, pulmão, pâncreas, coração, rim) dos animais do grupo de controlo e dos animais tratados com o extrato. O comportamento dos animais não foi alterado. Além disso, o consumo de água e de alimentos nos grupos tratados e de controlo foi semelhante. Em conjunto, estes resultados indicam que o extrato é seguro até 2000 mg/kg após administração oral (dados não mostrados).
Determinação do efeito nefroprotector
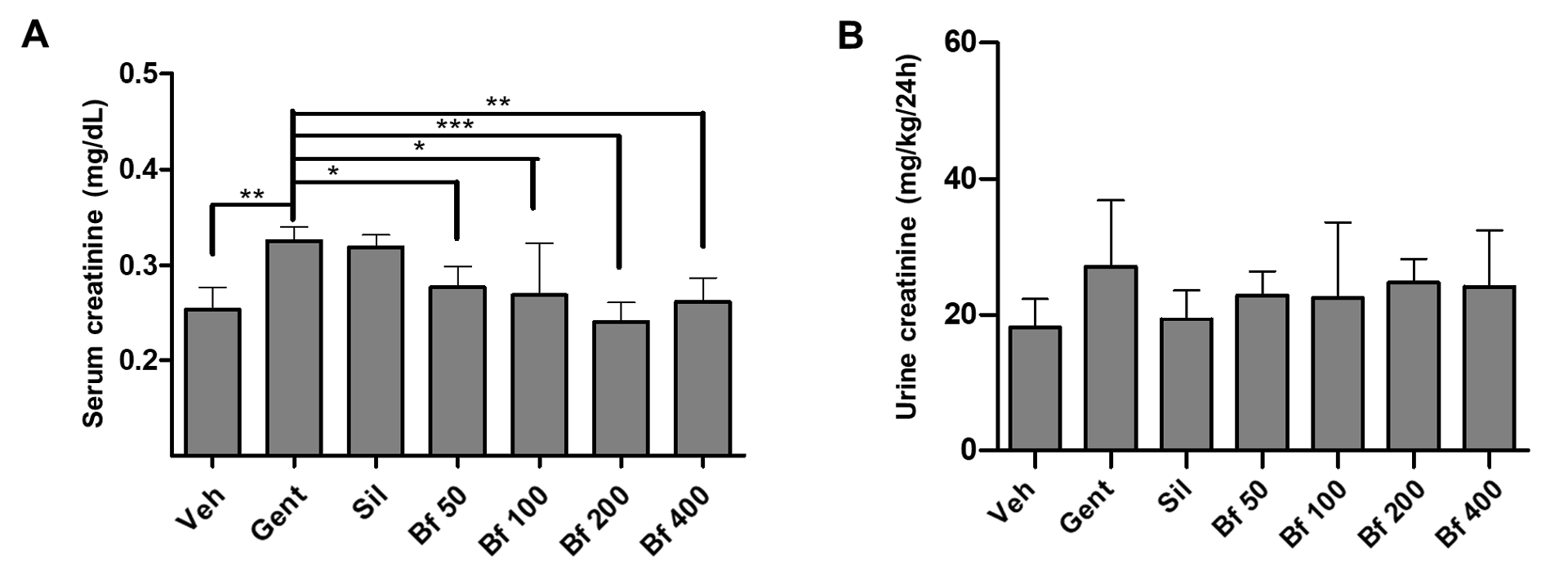
Foram utilizados ratinhos machos com lesões renais induzidas pela gentamicina. O principal marcador de lesão renal aguda foi a elevada concentração de creatinina no soro. Após nove dias, foi observada uma diferença estatisticamente significativa entre os grupos de controlo (Veh) e patológico (Gent) (grupo Gent 40% mais do que Veh, < 0,01), validando este modelo para identificar extractos de plantas com atividade nefroprotectora. Foi observado um efeito protetor ligeiro no grupo tratado com silimarina, uma vez que o nível de creatinina sérica neste grupo foi inferior ao do grupo patológico, mas esta diferença não foi significativa. Todas as doses testadas do extrato reduziram significativamente o nível de creatinina sérica (Bf 50 (78%) e Bf 100 (77%): p<0,05; Bf 200 (63%): p<0,001; Bf 400 (71%): p<0,01; Figura 1 A), em comparação com o grupo Gent. Os níveis de creatinina urinária não foram diferentes, embora os níveis em todos os grupos tratados com silimarina e extrato fossem comparáveis ao valor do grupo de controlo e inferiores aos do grupo patológico (Figura 1 B).
| Figura 1 - Efeito da Bauhinia forficata na concentração de creatinina no soro (A) e na urina (B), em ratinhos tratados com Veh: água, Gent: gentamicina, Sil: silimarina, Bf 50, Bf 100, Bf 200 e Bf 400 (B. forficata 50, 100, 200 e 400 mg/kg, p.o.). Os dados são expressos como média ± DP (n=6), ANOVA de uma via, teste post hoc de Dunnett. * p<0,05, ** p<0,01, ***p<0,001 significativamente diferente de Gent). |
 |
Os níveis séricos e urinários de ureia (Figuras 2 A e B) não foram alterados após o tratamento com B. forficata, quando comparados com o grupo Gent. Embora os níveis séricos de ureia tenham apresentado uma redução nos animais tratados com todas as doses do extrato, esta diferença não foi significativa (Figura 2 A).
| Figura 2 - Efeito da Bauhinia forficata na concentração de ureia no soro (A) e na urina (B), em ratinhos tratados com Veh: água, Gent: gentamicina, Sil: silimarina, Bf 50, Bf 100, Bf 200 e Bf 400 (B. forficata 50, 100, 200 e 400 mg/kg, p.o.). Os dados são expressos como média ± DP (n=6), ANOVA de uma via, teste post hoc de Dunnett. * p<0,05 significativamente diferente de Gent. |
 |
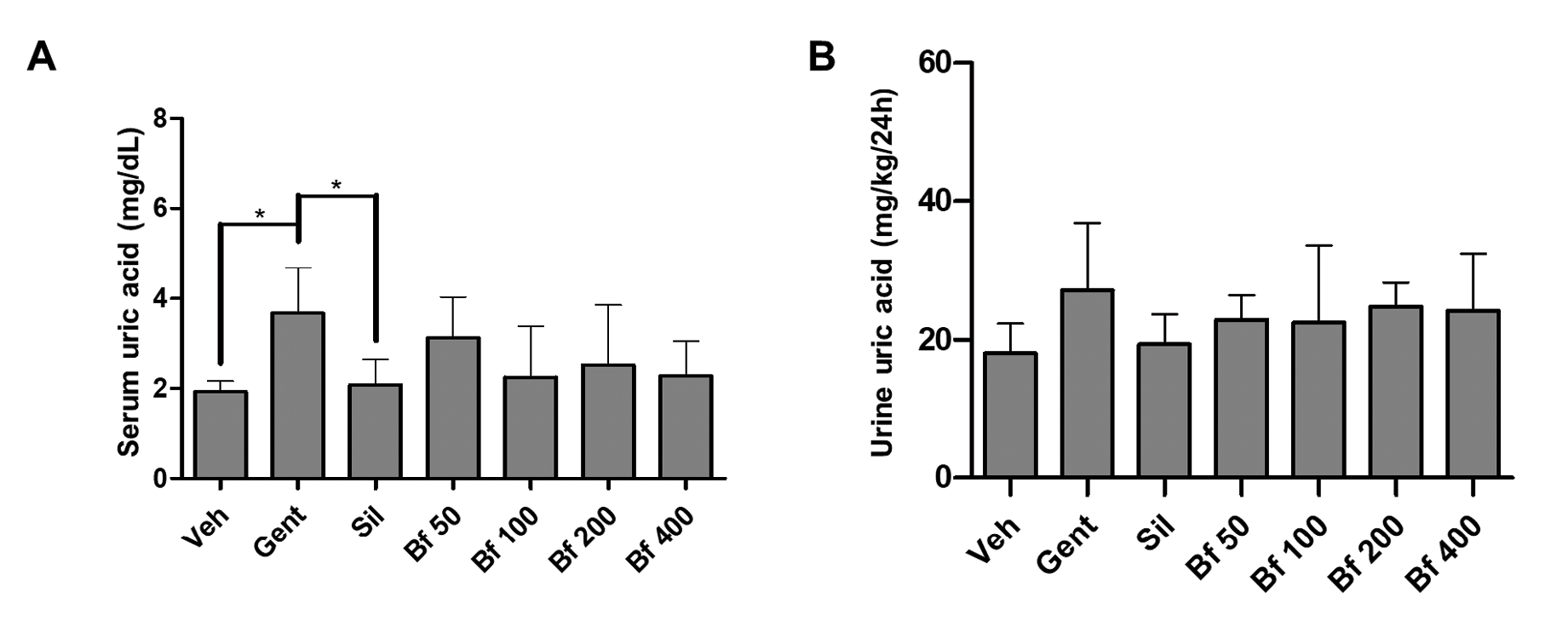
A concentração sérica de ácido úrico do grupo patológico (Gent) foi significativamente mais elevada em comparação com o controlo (86%, p<0,05) e com a silimarina (64%, p<0,05). Os animais tratados com o extrato (50, 100, 200 e 400 mg/kg), exibiram concentrações mais baixas do que o grupo Gent e estavam mais próximos do grupo da silimarina (Sil). Os níveis de ácido úrico na urina foram semelhantes em todos os grupos (Figuras 3A e 3B). Não foram observadas diferenças nos níveis de sódio e potássio no soro e na urina (Figuras 4 A-D).
| Figura 3 - Efeito da Bauhinia forficata na concentração de ácido úrico no soro (A) e na urina (B), em ratinhos tratados com Veh: água, Gent: gentamicina, Sil: silimarina, Bf 50, Bf 100, Bf 200 e Bf 400 (B. forficata 50, 100, 200 e 400 mg/kg, p.o.). Os dados são expressos como média ± DP (n=6), ANOVA de uma via, teste post hoc de Dunnett. * p<0,05 significativamente diferente de Gent. |
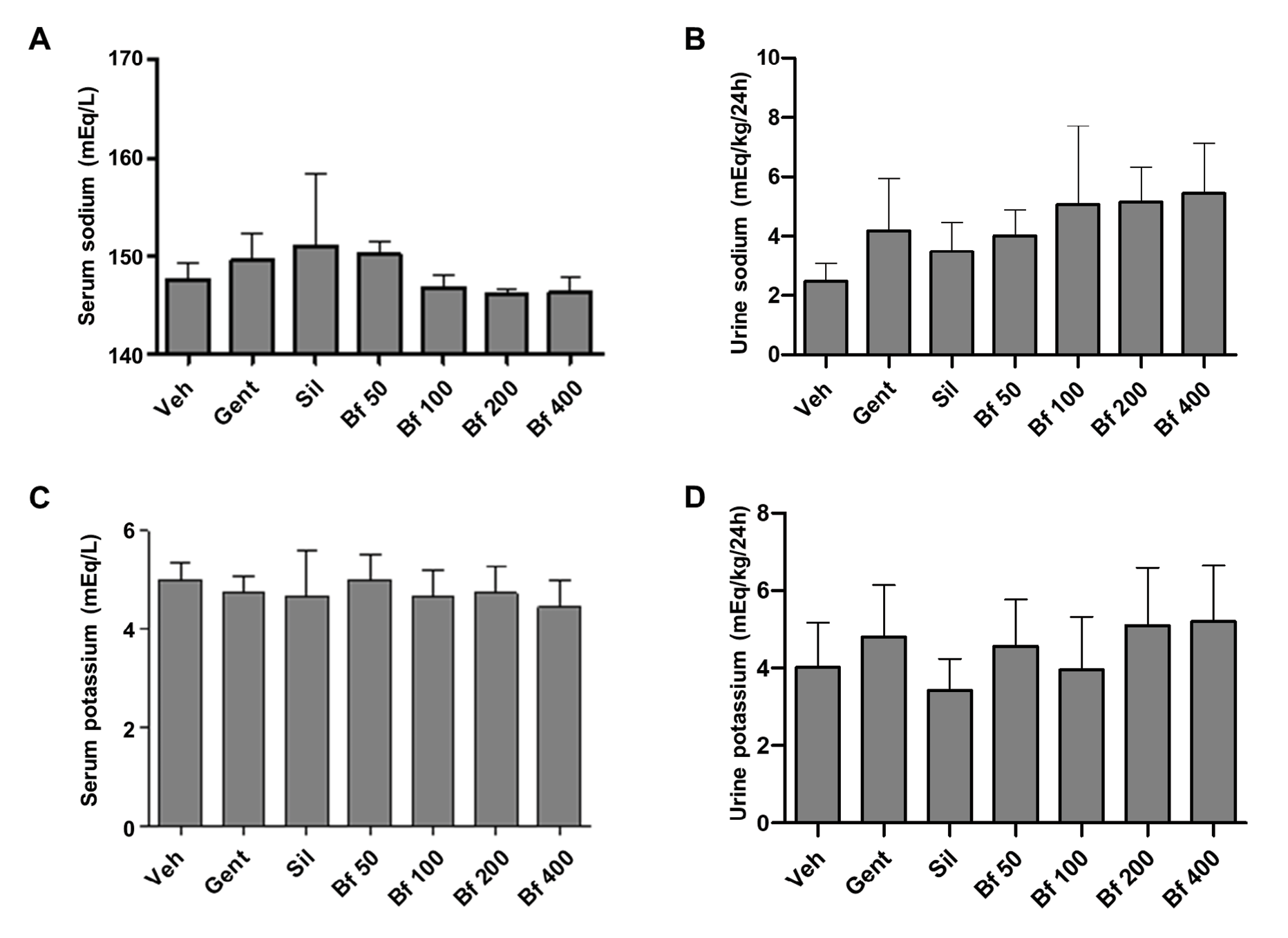 |
| Figura 4 - Efeito da Bauhinia forficata na concentração de sódio no soro (A) e na urina (B) e de potássio no soro (C) e na urina (D), em ratinhos tratados tratados com Veh: água, Gent: gentamicina, Sil: silimarina, Bf 50, Bf 100, Bf 200 e Bf 400 (B. forficata 50, 100, 200 e 400 mg/kg, p.o.). Os dados são expressos como média ± DP (n=6), ANOVA de uma via, teste post hoc de Dunnett. * p<0,05 significativamente diferente de Gent. |
 |
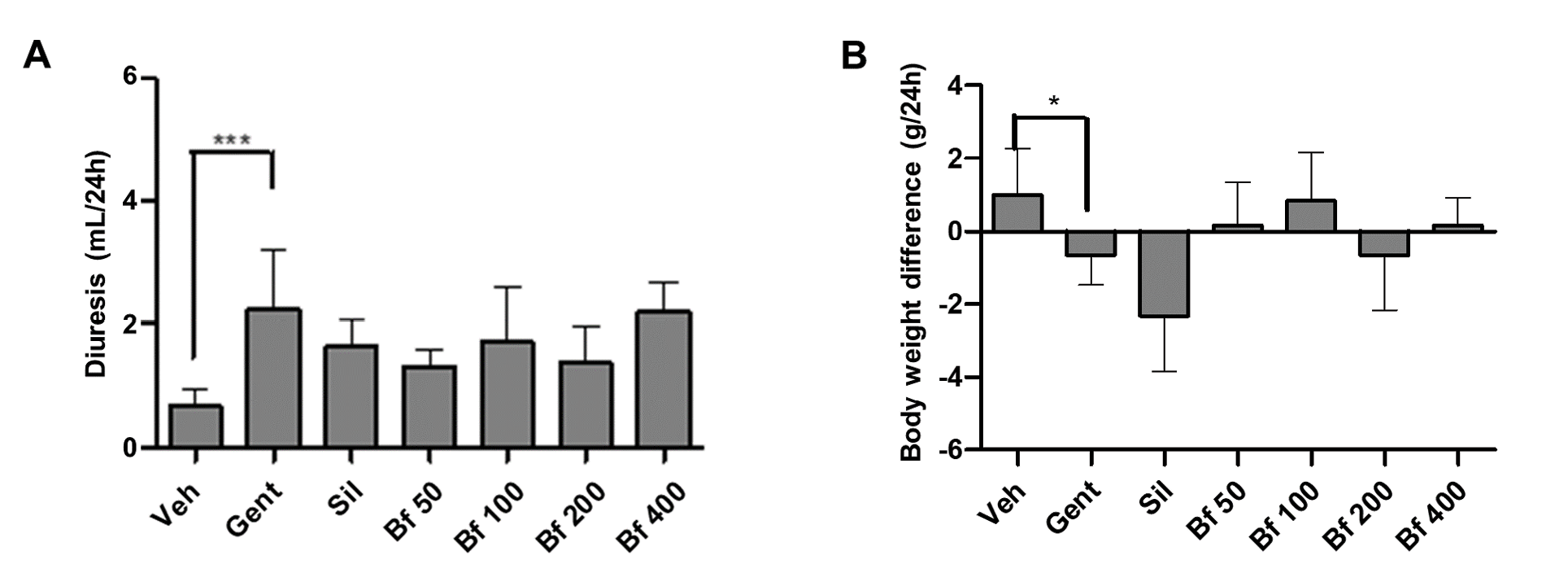
Por fim, foram avaliados a diurese, o peso corporal, a ingestão de alimentos e o consumo de água dos animais. Foi observada uma diferença significativa entre a diurese do grupo patológico (Gent) e a do grupo de controlo (Veh), uma vez que o volume de urina no grupo Gent era mais elevado. Os animais com lesões renais sofreram uma perda de peso significativa em comparação com o grupo de controlo, enquanto os animais tratados com o extrato (50, 100, 200 e 400 mg/kg) mantiveram o peso corporal muito próximo do grupo de controlo. Não se registou qualquer variação em termos de ingestão de alimentos ou de água pelos animais (Figuras 5A e 5B).
| Figura 5 - Efeito da Bauhinia forficata na diurese (A) e na diferença de peso corporal (B), em ratinhos tratados com Veh: água, Gent: gentamicina, Sil: silimarina, Bf 50, Bf 100, Bf 200 e Bf 400 (B. forficata 50, 100, 200 e 400 mg/kg, p.o.). Os dados são expressos como média ± DP (n=6), ANOVA de uma via, teste post hoc de Dunnett. |
 |
Determinação do efeito hepatoprotector
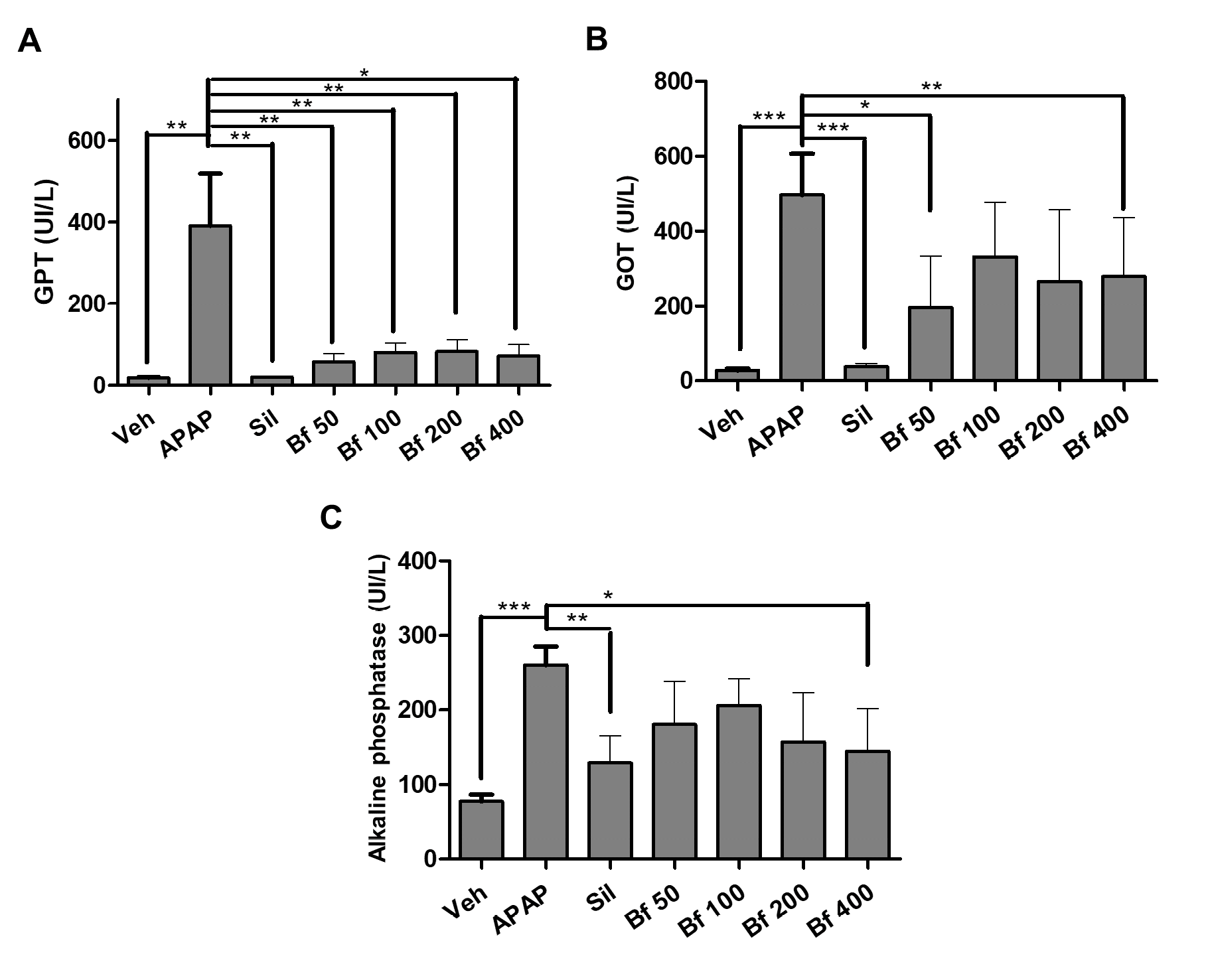
O principal marcador de danos no fígado foi a atividade da enzima GPT. Encontrámos uma diferença significativa (p<0,01) entre o grupo de controlo (Veh) e o grupo patológico (APAP), e entre o grupo APAP e a silimarina (Sil, p<0,01). Com estes resultados, verificou-se a validade do método para este tipo de estudo. O extrato de B. forficata preveniu a elevação da atividade da enzima GPT, evidenciada por uma diferença significativa entre os níveis de GPT quando comparados com o grupo APAP (50, p<0,01;100, p<0,01; 200, p<0,01; 400 p<0,05 mg/kg).
Em relação à atividade da enzima GOT, o grupo patológico (APAP) apresentou uma diferença significativa (p<0,001) em comparação com os animais do grupo de controlo (Veh) e os animais tratados com silimarina (Sil). O extrato de B. forficata impediu o aumento da atividade enzimática produzido pelo paracetamol, além disso, 50 (p<0,05) e 400 (p<0,01) mg/kg mostraram diferenças significativas quando comparados com o grupo APAP.
Finalmente, foi determinada a atividade da enzima fosfatase alcalina. A atividade da ALP do grupo patológico (APAP) foi estatisticamente diferente (p<0,001) dos grupos de controlo (Veh) e silimarina (Sil, (p<0,01)). Nos grupos que receberam o extrato, a atividade diminuiu, mas a diferença com o grupo APAP foi significativa (p<0,05) no grupo de animais que foi tratado com 400 mg/kg de B. forficata (Figuras 6A-C).
| Figura 6 - Níveis séricos (U/l) de GOT (A), GPT (B) e fosfatase alcalina (C) de ratinhos (n = 6) tratados com extrato de folhas de Bauhinia forficata. Veh: água, APAP: acetaminofeno, Sil: silimarina, Bf 50, Bf 100, Bf 200 e Bf 400 (B. forficata 50, 100, 200 e 400 mg/kg, p.o.). Os dados são apresentados como média ± DP. ANOVA de um fator, seguido pelo teste de Dunnett foi usado, p <0,05 foi considerado estatisticamente significativo (*p<0,05; **p<0,01; *** p <0,001, significativamente diferente do APAP). |
 |
Discussão
As plantas medicinais como potenciais agentes terapêuticos são de importância vital em todos os sistemas de saúde. Várias plantas provaram ser alternativas terapêuticas eficazes na prevenção e tratamento de diversas doenças do fígado e dos rins. O extrato metanólico das folhas de Bauhinia forficata testado neste estudo provou ser seguro, pelo menos até 2000 mg/kg, com base em testes de toxicidade aguda realizados em ratos e nos resultados descritos anteriormente. Foi anteriormente referido que esta planta é segura para utilização e não apresenta interacções medicamentosas (19). Os efeitos nefroprotectores e hepatoprotectores foram avaliados em ratinhos albinos suíços utilizando modelos de lesão renal e hepática quimicamente induzidas.
Os aminoglicosídeos têm efeitos nefrotóxicos devido à indução de espécies reactivas de oxigénio (ROS) e à depleção das actividades das enzimas antioxidantes no rim. A administração de gentamicina provocou alterações acentuadas nos túbulos renais devido à reabsorção de gentamicina nos túbulos contorcidos proximais, causando degeneração e necrose das células epiteliais dos túbulos. Estas alterações manifestaram-se através de túbulos dilatados, perda do bordo em escova, infiltrações leucocitárias graves, degeneração tubular e presença de cilindros tubulares (27).
A lesão renal induzida pela gentamicina caracteriza-se principalmente por um aumento da concentração de creatinina sérica, o que indica uma redução da taxa de filtração glomerular, estando frequentemente associada a um aumento da concentração sérica de ureia e de ácido úrico (28). Os nossos resultados mostraram que a administração diária de gentamicina durante nove dias (grupo Gent) aumentou a creatinina, a ureia e o ácido úrico no soro, em concordância com outros resultados relatados (28, 29). A concentração de creatinina na urina também aumentou ligeiramente, como esperado (29, 30).
O APAP é o modelo mais utilizado de lesão hepática intrínseca induzida por fármacos. O APAP é convertido num eletrófilo que se pensa ser a N-acetil-p-benzoquinona imina (NAPQI), catalisado pelas enzimas do citocromo P450. A NAPQI liga-se então a grupos sulfidrilo no glutatião e nas proteínas. A depleção de GSH torna as células mais susceptíveis ao stress oxidativo (31). A hepatotoxicidade foi conseguida através da administração intraperitoneal de paracetamol, 300 mg/kg de peso corporal, utilizada como administração única no último dia de tratamento. A lesão hepática foi evidenciada pela atividade elevada das enzimas hepáticas GPT, GOT e ALP (15-17).
A silimarina (150 mg/kg) foi utilizada nos ensaios de nefroprotecção e hepatoprotecção, como previamente descrito. A utilização da silimarina como controlo positivo em modelos de hepatoprotecção foi amplamente documentada e validada neste tipo de estudo (15, 16, 17, 30, 32). Além disso, o mecanismo do efeito hepatoprotector da silimarina foi previamente detalhado (8). Em contrapartida, nos modelos de ensaio de nefroprotecção, a utilização da silimarina para prevenir lesões renais é mais limitada; apesar disso, continua a ser a opção mais utilizada neste tipo de investigação (15, 32).
A silimarina atenuou o efeito tóxico da gentamicina em ratinhos (grupo Sil). Alguns relatórios indicaram que a silimarina tem um efeito modesto de nefroprotecção contra danos causados por agentes nefrotóxicos como a gentamicina (8), e o seu efeito nefroprotector foi demonstrado em investigações anteriores no nosso laboratório (16).
Todos os animais tratados com as doses testadas do extrato metanólico das folhas de B. forficata (50, 100, 200 e 400 mg/kg) preveniram a lesão renal causada pela gentamicina, evidenciada principalmente pela redução dos níveis de creatinina no soro (33, 34), em comparação com o grupo patológico (Gent). A ureia e o ácido úrico séricos nos grupos tratados com o extrato estavam mais próximos do valor medido no grupo de controlo (Veh), tal como referido na literatura quando foi avaliado o potencial nefroprotector dos extractos das sementes de Carica papaya (35) e da raiz de Croton zambesicus (36).
Tendo em conta que a planta é utilizada popularmente para o tratamento de distúrbios renais, foram também medidas as concentrações de creatinina, ureia e ácido úrico na urina, juntamente com o sódio e o potássio séricos e urinários. Concluimos que o extrato de B. forficata não tinha efeitos significativos nestes parâmetros (creatinina urinária, ureia e ácido úrico), em concordância com trabalhos anteriores relatados em Butea monosperma e Piper cubeba (33, 34). Da mesma forma, não se verificou qualquer diferença entre os níveis de electrólitos, nem no soro nem na urina, tal como referido para Carica papaya (35) e Croton zambesicus (36). Isto deve-se provavelmente ao facto de estes electrólitos estarem sujeitos a uma regulação fisiológica, metabólica e hormonal complexa (35), pelo que não foram observadas alterações significativas nos níveis destes componentes nas condições experimentais estabelecidas. A complexa regulação inclui a excreção renal, a ingestão de água, o equilíbrio dos electrólitos, a osmolaridade e o volume dos fluidos corporais, regulados pela vasopressina, aldosterona e o efeito dos osmorreceptores, entre outros (37).
Finalmente, a diurese, a variação do peso corporal, o consumo de alimentos e a ingestão de água dos diferentes grupos de teste foram também avaliados após 24 horas em gaiolas metabólicas. A diurese aumentou no grupo Gent, devido à diminuição do número de nefrónios funcionais e ao aumento da taxa de filtração. Algumas evidências indicam que os aminoglicosídeos interferem com a ação da vasopressina no néfron distal (38). O aumento da diurese em todos os grupos tratados com o extrato, em comparação com o grupo de controlo, deve-se ao conteúdo de flavonóides, previamente relatado como sendo responsável pela diurese (19). A análise do peso corporal, da alimentação e da bebida não foi relatada anteriormente, considerou-se que poderiam contribuir para o enriquecimento do modelo experimental utilizado, fornecendo novas evidências nos modelos patológicos utilizados. O grupo patológico apresentou menor peso corporal (p<0,05), e menor ingestão de alimentos e água (embora sem diferenças significativas). Uma redução significativa do peso corporal em ratinhos com lesão renal induzida por gentamicina numa experiência de 22 dias foi relatada anteriormente (39). Neste estudo, as diferenças relatadas correspondem ao peso dos animais após 24 horas em gaiolas metabólicas.
No que diz respeito ao teste de hepatoprotecção do extrato de B. forficata, verificou-se que todas as doses testadas (50, 100, 200 e 400 mg/kg) se revelaram eficazes na proteção dos ratinhos contra as lesões hepáticas causadas pelo paracetamol. Estes resultados estão de acordo com os obtidos com outra espécie do mesmo género, Bauhinia variegata (40). A presença de ácido gálico e de pelo menos 39 flavonóides, como a rutina, a quercetina e o kaempferol, foi registada na Bauhinia forficata (22, 41, 42). Estes compostos têm propriedades antioxidantes devido à capacidade de neutralizar espécies oxidantes, como os radicais superóxido. A atividade antioxidante da B. forficata tem sido amplamente demonstrada e associada à composição de flavonóides (19), tal como a atividade relatada em estudos de um extrato de folhas de Bauhinia variegata (12). O efeito hepatoprotector em ratinhos diabéticos foi previamente relatado, e o efeito atribuído ao conteúdo fenólico (43). Além disso, foi também registada a presença de trigonelina, um alcaloide antioxidante (44). Outras espécies, com componentes em comum, como Opuntia ficus indica e Zea mais, demonstraram um efeito hepatoprotector semelhante, pelo que pode ser que o mecanismo intrínseco pelo qual estas plantas exercem o seu efeito esteja associado à sua capacidade antioxidante (15).
Foram relatadas diferentes actividades farmacológicas para muitas espécies de Bauhinia, incluindo as hepatoprotectora e antioxidante. As folhas de Bauhinia forficata têm efeitos antidiabéticos, antioxidantes, antibacterianos, antiproliferativos, antiulcerogénicos, anti-inflamatórios e hepatoprotectores em ratinhos diabéticos, entre outros (19). O presente estudo foi realizado para avaliar as actividades protectoras do extrato metanólico das folhas de Bauhinia forficata em ratinhos induzidos a hepatotoxicidade e nefrotoxicidade agudas. Estes resultados preliminares indicam que será importante continuar com a avaliação do efeito deste extrato noutros parâmetros que nos permitam determinar a capacidade antioxidante e as acções anti-inflamatórias e anti-stress oxidativo. São necessários mais estudos para compreender as vias mecanicistas da proteção observada.
Conclusão
A avaliação preliminar do extrato metanólico das folhas de Bauhinia forficata demonstrou uma atividade nefroprotectora moderada em ratinhos com lesões renais induzidas pela gentamicina, conseguindo um controlo significativo da alteração da concentração de creatinina sérica. O extrato afectou ligeiramente os valores séricos de ureia e ácido úrico e teve um efeito muito reduzido nos parâmetros de urina medidos. Além disso, foi demonstrado que o extrato tem uma atividade hepatoprotectora marcada. Os nossos resultados in vivo validam parcialmente a utilização popular da B. forficata. Serão necessárias mais experiências para avaliar os seus efeitos nos tecidos, elucidar o mecanismo e identificar os compostos responsáveis pelo efeito observado.
Fontes de financiamento
Esta pesquisa foi apoiada pela Facultad de Ciencias Químicas e pelo Instituto de Investigaciones en Ciencias de la Salud, da Universidad Nacional de Asunción, Paraguai. SFR realizou o trabalho durante seu programa de mestrado (MCB) apoiado pelo CONACYT, Programa PROCIENCIA, recursos do FEEI do FONACIDE, Paraguai (PROCIENCIA POSG17-59).
Contribuição dos autores
SFR e AKG efectuaram ensaios e recolheram dados. SFR, MLK e MACB analisaram os dados. PMFT, MAC-B e MLK conceberam e projectaram as experiências. MAC-B e MLK redigiram o artigo. Todos os autores leram e concordaram com a versão publicada do manuscrito.
Agradecimentos
Os autores gostariam de agradecer à equipa do Professor R. Degen, que recolheu e identificou o material vegetal, ao Dr. N. Alvarenga, que forneceu o extrato, e ao Sr. N. Kennedy pela revisão da língua inglesa.
Conflitos de interesses
Os autores declaram que não têm interesses concorrentes.
Referências
1. Cosola., C., Sabatino., A, Di Bari., I., Fiaccadori., E., & Gesualdo., L. (2018). Nutrients, Nutraceuticals, and Xenobioti.cs Affecting Renal Health. Nutrients, 10(7), 808. https://doi.org/10.3390/nu10070808
2. Gu, X., & Manautou, J. E. (2012). Molecular mechanisms underlying chemical liver injury. Expert reviews in molecular medicine, 14, e4. https://doi.org/10.1017/S1462399411002110
3. Prikhodko., V., Bezborodkina., N. & Okovityi., S. (2022). Pharmacotherapy for Non-Alcoholic Fatty Liver Disease: Emerging Targets and Drug Candidates. Biomedicines, 10(2), 274. doi: 10.3390/biomedicines10020274
4. Instituto Nacional de Nefrología. (2019). Informe INN, Hemodiálisis Crónica. Available at: 6b307e-Informe2019INN.pdf (mspbs.gov.py)
5. Luyckx, V. A., Al-Aly, Z., Bello, A. K., Bellorin-Font, E., Carlini, R. G., Fabian, J., Garcia-Garcia, G., Iyengar, A., Sekkarie, M., van Biesen, W., Ulasi, I., Yeates, K., & Stanifer, J. (2021). Sustainable Development Goals relevant to kidney health: an update on progress. Nature reviews. Nephrology, 17(1), 15–32. https://doi.org/10.1038/s41581-020-00363-6
6. Kalra, A., Yetiskul, E., Wehrle, C. J., & Tuma, F. (2023). Physiology, Liver. In StatPearls. StatPearls Publishing.
7. Ye, F., Zhai, M., Long, J., Gong, Y., Ren, C., Zhang, D., Lin, X., & Liu, S. (2022). The burden of liver cirrhosis in mortality: Results from the global burden of disease study. Frontiers in public health, 10, 909455. https://doi.org/10.3389/fpubh.2022.909455
8. Kim., Y., Na., J., Kwon., D. & Park., J. (2018). Silymarin prevents acetaminophen-induced hepatotoxicity via up-regulation of the glutathione conjugation capacity in mice. Journal of functional food, 49, 235-240. https://doi.org/10.1016/j.jff.2018.08.025
9. Adeneye., A. & Benebo., A. (2008). Protective effect of the aqueous leaf and seed extract of Phyllanthus amarus on gentamicin and acetaminophen-induced nephrotoxic rats. Journal of Ethnopharmacology, 118(2), 318-323. https://doi.org/10.1016/j.jep.2008.04.025
10. Khan, S. A., Priyamvada, S., Farooq, N., Khan, S., Khan, M. W., & Yusufi, A. N. (2009). Protective effect of green tea extract on gentamicin-induced nephrotoxicity and oxidative damage in rat kidney. Pharmacological research, 59(4), 254–262. https://doi.org/10.1016/j.phrs.2008.12.009
11. Dungca., N. (2016). Protective effect of the methanolic leaf extract of Eclipta alba (L.) Hassk. (Asteraceae) against gentamicin-induced nephrotoxicity in Sprague Dawley rats. Journal of Ethnopharmacology, 184, 18-21. doi:10.1016/j.jep.2016.03.002
12. Bashandy, S. A. E., El Awdan, S. A., Mohamed, S. M., & Omara, E. A. A. (2020). Allium porrum and Bauhinia Variegata mitigate acute liver failure and nephrotoxicity induced by thioacetamide in male rats. Indian journal of clinical biochemistry : IJCB, 35(2), 147–157. https://doi.org/10.1007/s12291-018-0803-5
13. Hina., G., Muhammad., A., Salina., S., Yazeed., A., Falak., S., Eilaf., A., Umara., A., Syed., M., Asghar., K., Muhammad., G. & Ghazala., K. (2021). Quantification of biochemical compounds in Bauhinia Variegata Linn flower extract and its hepatoprotective effect. Saudi Journal of Biological Sciences, 28(1), 247-254. https://doi.org/10.1016/j.sjbs.2020.09.056
14. Oliveira, G. O., Braga, C. P., & Fernandes, A. A. (2013). Improvement of biochemical parameters in type 1 diabetic rats after the roots aqueous extract of yacon [Smallanthus sonchifolius (Poepp.& Endl.)] treatment. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 59, 256–260. https://doi.org/10.1016/j.fct.2013.05.050
15. Ben Saad, A., Dalel, B., Rjeibi, I., Smida, A., Ncib, S., Zouari, N., & Zourgui, L. (2017). Phytochemical, antioxidant and protective effect of cactus cladodes extract against lithium-induced liver injury in rats. Pharmaceutical biology, 55(1), 516–525. https://doi.org/10.1080/13880209.2016.1255976
16. Soverina., M., Campuzano-Bublitz., M., Centurión., J., Galeano., A. & Kennedy., M. (2019). Preliminary evaluation of hepatoprotective and nephroprotective effects of Prosopis ruscifolia Griseb. leaves extract in mice. Journal of Applied Pharmaceutical Sciences 9(12), 37-41. doi: 10.7324/JAPS.2019.91206
17. Velázquez., A., Diarte., E., Henichen., O., Montalbetti., Y., Campuzano-Bublitz., M., Kennedy., M., Hellión-Ibarrola., M. & Ibarrola., D. (2020). Baccharis crispa attenuates toxic hepatitis induced by acetaminophen and carbon tetrachloride in mice. Journal of Applied Pharmaceutical Science 10(11), 110-116. doi: 10.7324/JAPS.2020.101115
18. Velázquez., A., Diarte., E., Galeano., A., Burgos-Edwards., A., Alvarenga., N., Heinichen., O., Montalbetti., Y., Campuzano-Bublitz., M., Kennedy., M., Hellión-Ibarrola., M. & Ibarrola., D. (2021). Hepatoprotective activity of Dorstenia brasiliensis against acute hepatitis induced by acetaminophen and carbon tetrachloride in mice, International Journal of Pharmaceutical Sciences and Research,12, 6384-6392. doi: 10.13040/IJPSR.0975-8232.12(12).6384-92
19. Cechinel-Zanchett., C., de Andrade., S. & Cechinel-Filho., V. (2018). Ethnopharmacological, Phytochemical, Pharmacological and Toxicological Aspects of Bauhinia forficata: A Mini-Review Covering the Last Five Years. Natural Product Communications 13(7), 911-916. doi:10.1177/1934578X1801300732
20. Cechinel-Zanchett., C., Melo., R., Tenfen., A., Siebert., D., Micke., G., Vitali., G., Cechinel-Filho., V., Faloni., S. & de Souza., P. (2019). Bauhinia forficata link, a Brazilian medicinal plant traditionally used to treat cardiovascular disorders, exerts endothelium-dependent and independent vasorelaxation in thoracic aorta of normotensive and hypertensive rats. Journal of Ethnopharmacology 243, 112118. https://doi.org/10.1016/j.jep.2019.112118
21. Miceli., N., Buongiorno., L., Celi., M., Cacciola., F., Dugo., P., Donato., P., Mondello., L., Bonaccorsi., I. & Taviano., M. (2016). Role of the flavonoid-rich fraction in the antioxidant and cytotoxic activities of Bauhinia forficata Link. (Fabaceae) leaves extract. Natural product research, 11, 1229-1239. doi: 10.1080/14786419.2015.1050671
22. Cechinel-Filho., V. (2009). Chemical composition and biological potential of plants from the genus Bauhinia. Phytotherapy Research 23(10), 1347-1354. https://doi.org/10.1002/ptr.2756
23. National Research Council (US). (2011). Guide for the care and use of laboratory animals. 8th ed. Washington, United States. National Academies Press (US). Available at: https://www.ncbi.nlm.nih.gov/books/NBK54050/ doi: 10.17226/12910
24. Organisation for Economic Co-operation and Development (OECD). Guidelines for the Testing of Chemicals, (2022). Oecd.org. Available at: https://www.oecd.org/chemicalsafety/testing/15487898
25. Dufour., D., Lott., J., Nolte., F., Gretch., D., Koff., R. & Seeff., L. (2000). Diagnosis and Monitoring of Hepatic Injury. I. Performance Characteristics of Laboratory Tests. Clinical Chemistry 46(12), 2027-2049. doi.org/10.1093/clinchem/46.12.2027.
26. Strömme., J. & Eldjam., L. (1974). Scandinavian Standardizations of Enzyme Determination. Scandinavian journal of clinical and laboratory investigation, 33(4), 287–289. doi: 10.1080/00365517409082498
27. Randjelovic, P., Veljkovic, S., Stojiljkovic, N., Sokolovic, D., & Ilic, I. (2017). Gentamicin nephrotoxicity in animals: Current knowledge and future perspectives. EXCLI journal, 16, 388–399. https://doi.org/10.17179/excli2017-165.
28. Raju, S., Kavimani, S., Maheshwara Rao, V. U., Reddy, K. S., & Kumar, G. V. (2011). Floral extract of Tecoma stans: a potent inhibitor of gentamicin-induced nephrotoxicity in vivo. Asian Pacific journal of tropical medicine, 4(9), 680–685. https://doi.org/10.1016/S1995-7645(11)60173-9
29. Rajamurugan., R., Suyavaran., A., Selvaganabathy., N., Ramamurthy., C., Reddy., G., Sujatha., V. & Thirunavukkarasu., C. (2012). Brassica nigra plays a remedy role in hepatic and renal damage. Pharmaceutical Biology 50(12), 1488-1497. doi: 10.3109/13880209.2012.685129
30. Abdel-Kader., M., Alanazi., M., Bin., A., Al-Saikhan., F. & Hamad., A. (2017). Hepatoprotective and nephroprotective activities of Juniperus sabina L aerial. parts. Journal of Pharmacy & Pharmacognosy Research, 5(1), 29-39.
31. McGill, M. R., & Jaeschke, H. (2019). Animal models of drug-induced liver injury. Biochimica et biophysica acta. Molecular basis of disease, 1865(5), 1031–1039. https://doi.org/10.1016/j.bbadis.2018.08.037
32. Ezejiofor., A., Orish., C. & Orisakwe., O. (2014). Costus afer ker gawl leaves against gentamicin-induced nephrotoxicity in rats. Iranian Journal of Kidney Diseases. 8(4), 310-313. PMID: 25001137
33. Sonkar, N., Ganeshpurkar, A., Yadav, P., Dubey, S., Bansal, D., & Dubey, N. (2014). An experimetal evaluation of nephroprotective potential of Butea monosperma extract in albino rats. Indian journal of pharmacology, 46(1), 109–112. https://doi.org/10.4103/0253-7613.125190
34. Ahmad, Q. Z., Jahan, N., Ahmad, G., & Tajuddin (2012). Nephroprotective effect of Kabab chini (Piper cubeba) in gentamycin-induced nephrotoxicity. Saudi journal of kidney diseases and transplantation : an official publication of the Saudi Center for Organ Transplantation, Saudi Arabia, 23(4), 773–781. https://doi.org/10.4103/1319-2442.98159
35. Olagunju., J., Adeneye., A., Fagbohunka., B., Bisuga., N., Ketiku., A., Benebo., A., Olufowobi., O., Adeoye., A., Alimi., M. & Adeleke., A. (2009). Nephroprotective activities of the aqueous seed extract of Carica papaya Linn. in carbon tetrachloride induced renal injured Wistar rats: a dose- and time-dependent study. Biology and Medicine 1(1):11-19.
36. Okokon, J. E., Nwafor, P. A., & Noah, K. (2011). Nephroprotective effect of Croton zambesicus root extract against gentimicin-induced kidney injury. Asian Pacific journal of tropical medicine, 4(12), 969–972. https://doi.org/10.1016/S1995-7645(11)60228-9
37. Atherton., J. (2006). Regulation of fluid and electrolyte balance by the kidney. Anaesthesia & Intensive Care Medicine 7(7), 227–233. https://doi.org/10.1053/j.mpaic.2006.04.002
38. Kaloyanides, G. J., & Pastoriza-Munoz, E. (1980). Aminoglycoside nephrotoxicity. Kidney international, 18(5), 571–582. https://doi.org/10.1038/ki.1980.175
39. Govindappa., P.K., Gautam., V, Tripathi., S.M., Sahni., Y.P., Raghavendra., H.L. (2019). Effect of Withania somnifera on gentamicin induced renal lesions in rats. Revista Brasileira de Farmacognosia 29, 234–240. https://doi.org/10.1016/j.bjp.2018.12.005
40. Bodakhe., S. & Ram., A. (2007). Hepatoprotective properties of Bauhinia variegata bark extract. Yakugaku Zasshi. Journal of the Pharmaceutical Society of Japan 127(9),1503–1507. doi: 10.1248/yakushi.127.1503
41. Silva., K. & Cechinel-Filho., V. (2002). Plantas do gênero Bauhinia: composição química e potencial farmacológico. Química Nova, 3, 449-454. https://doi.org/10.1590/S0100-40422002000300018
42. Franco, R. R., Mota Alves, V. H., Ribeiro Zabisky, L. F., Justino, A. B., Martins, M. M., Saraiva, A. L., Goulart, L. R., & Espindola, F. S. (2020). Antidiabetic potential of Bauhinia forficata Link leaves: a non-cytotoxic source of lipase and glycoside hydrolases inhibitors and molecules with antioxidant and antiglycation properties. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 123, 109798. https://doi.org/10.1016/j.biopha.2019.109798
43. Salgueiro, A. C., Folmer, V., da Silva, M. P., Mendez, A. S., Zemolin, A. P., Posser, T., Franco, J. L., Puntel, R. L., & Puntel, G. O. (2016). Effects of Bauhinia forficata Tea on Oxidative Stress and Liver Damage in Diabetic Mice. Oxidative medicine and cellular longevity, 2016, 8902954. https://doi.org/10.1155/2016/8902954
44. Toloza-Zambrano., P., Avello., M. &Fernandez., P. (2015). Determination of rutin and trigonelline in extracts of Bauhinia forficata subsp. pruinosa and hypoglycemic effect on diabetic and prediabetic patients humans. Boletín Latinoamericano y Del Caribe De Plantas Medicinales y Aromáticas, 14 (1), 21–32.
